Titrimetriya

Titrlash (shuningdek, titrimetriya[1] va hajmli tahlil deb ham ataladi) aniqlangan tahlil qiluvchi moddaning (tahlil qilinadigan modda) kontsentratsiyasini aniqlash uchun miqdoriy kimyoviy tahlilning keng tarqalgan laboratoriya usuli hisoblanadi. Titrant yoki titrator deb ataladigan reagent[2] konsentratsiyasi va hajmi maʼlum boʻlgan standart eritma sifatida tayyorlanadi. Titrant analitning konsentratsiyasini aniqlash uchun analit eritmasi (uni titrand[3] deb ham atash mumkin) bilan reaksiyaga kirishadi. Analit bilan reaksiyaga kirishgan titrant hajmi titrlash hajmi deb ataladi.
Tarix va etimologiya
[tahrir | manbasini tahrirlash]"Titrlash" soʻzi fransuzcha titrer (1543) soʻzidan kelib chiqqan boʻlib, tangalardagi yoki oltin yoki kumushdan yasalgan buyumlardagi oltin yoki kumushning ulushini yaʼni noziklik yoki poklik oʼlchovi bildiradi; Tiltre titrga aylandi,[4] shu tariqa “qotishma oltinning nozikligi”[5], soʻngra “maʼlum namunadagi moddaning konsentratsiyasi” degan maʼnoni anglatadi.[6] 1828-yilda fransuz kimyogari Jozef Lui Gey- Lyusak birinchi marta titrni (titr) sifatida ishlatgan, bu "maʼlum namunadagi moddaning konsentratsiyasini aniqlash" degan maʼnoni anglatadi.[7]
Volumetrik tahlil XVII-asr oxirida Fransiyada paydo boʻlgan. Fransua-Antuan-Anri Deskruizil (fr) 1791-yilda birinchi byuretkani ishlab chiqdi[8][9][10] Gey-Lyussak byuretkaning yon qoʻlni oʻz ichiga olgan takomillashtirilgan versiyasini ishlab chiqdi va 1824-yilda indigo eritmalarini standartlashtirish bo'yicha maqolada " pipetka " va "byuretka " atamalarini ixtiro qildi.[11] Birinchi haqiqiy byuretka 1845-yilda fransuz kimyogari Etyen Ossian Genri (1798-1873) tomonidan ixtiro qilingan.[12][13][14][15] Volumetrik tahlil usulining katta takomillashuvi va ommalashishi byuretkani oddiy va qulay shaklga aylantirgan va ushbu mavzu boʻyicha birinchi darslikni 1855-yilda nashr etgan.[16][17]
Ishlash jarayoni
[tahrir | manbasini tahrirlash]
Odatiy titrlash, oʻz ichiga juda aniq miqdorda tahlil qiluvchi va oz miqdorda indikator (masalan, fenolftalein) solingan stakan yoki Erlenmeyer kolbasi bilan, titrantni oʻz ichiga olgan kalibrlangan byuretka yoki kimyoviy pipetlash shpritslari ostiga qoʻyishdan boshlanadi.[18] Keyin analit va indikatorga kichik hajmdagi titrant qoʻshiladi va indikator titrantning to'yinganlik chegarasiga reaksiya sifatida rangini oʻzgartiradi, bu titrlashning yakuniy nuqtasiga yetib borishini anglatadi, yaʼni titrant miqdori mavjud analit miqdorini muvozanatlashtiradi. Istalgan soʻnggi nuqtaga qarab, titrantning bir tomchi yoki bir tomchidan kamroq miqdori indikatorning doimiy va vaqtinchalik oʻzgarishi oʻrtasidagi farqni keltirib chiqarishi mumkin.
Tayyorlash texnikasi
[tahrir | manbasini tahrirlash]Odatda titrlashlar titrant va analitning suyuq (eritma) shaklida boʻlishini talab qiladi. Qattiq moddalar odatda suvli eritmada eritilsada, boshqa erituvchilar, masalan, muzli sirka kislotasi yoki etanol neftga ixtisoslashgan maxsus maqsadlarda (neft kimyosida boʻlgani kabi) ishlatiladi.[19] Aniqlikni oshirish uchun konsentrlangan analitlar koʻpincha suyultiriladi.
Koʻpgina kislotali boʻlmagan titrlashlar reaksiya davomida doimiy pH ni talab qiladi. Shuning uchun pH ni ushlab turish uchun titrlash kamerasiga bufer eritma qoʻshilishi mumkin.[20]
Namunadagi ikkita reaktiv titrant bilan reaksiyaga kirishishi mumkin boʻlgan va faqat bittasi kerakli analit boʻlgan hollarda, reaksiya kamerasiga kiruvchi ion taʼsirini bartaraf etadigan alohida indikatorli eritma qoʻshilishi mumkin.[21]
Baʼzi oksidlanish-qaytarilish(qaytarilish-qaytarilish) reaksiyalari reaksiya tezligini oshirish uchun namuna eritmasini qizdirish va eritma hali issiq boʻlganda titrlashni talab qilishi mumkin. Masalan, ba'zi oksalat eritmalarining oksidlanishi 60 °C (140 °F) ga qizdirishni reaksiyaning oʻrtacha tezligini saqlab qolish uchun talab qiladi[22]
Titrlash egri chiziqlari
[tahrir | manbasini tahrirlash]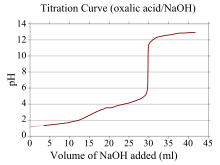
Titrlash egri chizigʻi grafikdagi egri chiziq boʻlib, uning x koordinatasi titrlash boshidan beri qoʻshilgan titrant hajmini, y koordinatasi esa titrlashning tegishli bosqichidagi tahlil qiluvchi moddaning konsentratsiyasini koʻrsatadi. kislota-asosli titrlash, y koordinata odatda eritmaning pH ni ifodalaydi).[23]
Kislota-asosli titrlashda titrlash egri chizigʻi mos keladigan kislota va asosning kuchini ifodalaydi. Kuchli kislota va kuchli asos uchun egri chiziq nisbatan silliq va ekvivalentlik nuqtasi yaqinida juda tik boʻladi. Shu sababli, ekvivalent nuqtaga yaqin titrant hajmining kichik o'zgarishi katta pH oʻzgarishiga olib keladi va ko'plab koʻrsatkichlar mos keladi (masalan, lakmus, fenolftalein yoki bromotimol ko'k).
Agar reagentlardan biri zaif kislota yoki asos, ikkinchisi esa kuchli kislota yoki asos boʻlsa, titrlash egri chizigʻi tartibsiz boʻladi va ekvivalent nuqtaga yaqin titrantning kichik qoʻshilishi bilan pH kamroq siljiydi. Masalan, oksalat kislotasi (kuchsiz kislota) va natriy gidroksid (kuchli asos) oʻrtasidagi titrlash uchun titrlash egri chizigʻi tasvirlangan. Ekvivalentlik nuqtasi pH 8-10 oraligʻida boʻladi, bu ekvivalent nuqtada eritmaning asosiy ekanligini va fenolftalein kabi indikator mos kelishini ko'rsatadi. Kuchsiz asoslar va kuchli kislotalarga mos keladigan titrlash egri chiziqlari xuddi shunday harakat qiladi, eritma ekvivalent nuqtasida kislotali boʻladi va metil oranj va bromotimol koʻk kabi koʻrsatkichlar eng mos keladi.
Kuchsiz kislota va kuchsiz asos o'rtasidagi titrlashlar juda tartibsiz titrlash egri chiziqlariga ega. Shu sababli, hech qanday aniq indikator mos kelmasligi mumkin va reaksiyani kuzatish uchun koʻpincha pH oʻlchagich ishlatiladi.[24]
Egri chiziqni tasvirlash uchun ishlatilishi mumkin boʻlgan funksiya turi sigmasimon funksiya deb ataladi.
Titrlash turlari
[tahrir | manbasini tahrirlash]Turli xil protseduralar va maqsadlarga ega titrlashning koʻplab turlari mavjud. Sifatli titrlashning eng keng tarqalgan turlari kislota-asosli titrlash va redoks titrlashdir.
Kislota-asos titrlash
[tahrir | manbasini tahrirlash]
| Ko'rsatkich | Kislotali tomonda rang | Rang o'zgarishi diapazoni </br> (pH) |
Asosiy tomonda rang |
|---|---|---|---|
| Metil binafsha | Sariq | 0,0–1,6 | binafsha |
| Bromofenol ko'k | Sariq | 3,0–4,6 | Moviy |
| Metil oranj | Qizil | 3.1–4.4 | Sariq |
| Metil qizil | Qizil | 4.4–6.3 | Sariq |
| Lakmus | Qizil | 5,0-8,0 | Moviy |
| Bromotimol ko'k | Sariq | 6,0–7,6 | Moviy |
| Fenolftalein | Rangsiz | 8,3–10,0 | Pushti |
| Alizarin sariq | Sariq | 10,1–12,0 | Qizil |
Kislota-asos titrlashlari eritmada aralashtirilganda kislota va asos oʻrtasidagi neytrallanishga bogʻliq. Namunaga qoʻshimcha ravishda titrlash kamerasiga ekvivalentlik nuqtasining pH diapazonini ifodalovchi tegishli pH indikatori qoʻshiladi. Kislota-asos koʻrsatkichi rangni oʻzgartirish orqali titrlashning yakuniy nuqtasini koʻrsatadi. Yakuniy nuqta va ekvivalentlik nuqtasi mutlaqo bir xil emas, chunki ekvivalentlik nuqtasi reaksiyaning stokiometriyasi bilan belgilanadi, oxirgi nuqta esa indikatordan faqat rang oʻzgarishidir. Shunday qilib, indikatorni ehtiyotkorlik bilan tanlash indikator xatosini kamaytiradi. Misol uchun, agar ekvivalentlik nuqtasi pH 8,4 boʻlsa, u holda fenolftalein indikatori Alizarin sariq oʻrniga ishlatiladi, chunki fenolftalein indikator xatosini kamaytiradi. Umumiy koʻrsatkichlar, ularning ranglari va rangini o'zgartiradigan pH diapazoni yuqoridagi jadvalda keltirilgan.[25] Aniqroq natijalar talab qilinganda yoki reagentlar zaif kislota va zaif asos boʻlsa, pH oʻlchagich yoki oʻtkazuvchanlik oʻlchagich ishlatiladi.
Organolitiy reagenti, metall amidlari va gidridlari kabi juda kuchli asoslar uchun suv odatda mos erituvchi emas va pKa suvli pH oʻzgarishlari oraligʻida boʻlgan koʻrsatkichlar kam qoʻllanadi. Buning oʻrniga titrant va indikator ancha zaif kislotalar va THF kabi suvsiz erituvchilar ishlatiladi.[26][27]

Titrlash paytida taxminan pH ni uch xil hisob-kitoblar yordamida taxmin qilish mumkin. Titrlashni boshlashdan oldin, konsentratsiyasi<math xmlns="http://www.w3.org/1998/Math/MathML"><semantics><mrow class="MJX-TeXAtom-ORD"><mstyle displaystyle="true" scriptlevel="0"><mrow class="MJX-TeXAtom-ORD"><mrow class="MJX-TeXAtom-ORD"><mo stretchy="false"></mo><msup><mtext> </mtext><mrow class="MJX-TeXAtom-ORD"><mo> </mo></mrow></msup><mo stretchy="false"> </mo></mrow></mrow></mstyle></mrow><annotation encoding="application/x-tex"> </annotation></semantics></math></img> har qanday asosni qoʻshishdan oldin kuchsiz kislotaning suvli eritmasida hisoblanadi. Qoʻshilgan asoslarning mollari soni boshlangʻich kislota yoki ekvivalentlik nuqtasi deb ataladigan mol soniga teng boʻlsa, gidrolizdan biri va pH titrlangan kislotaning konjugat asoslari hisoblangan tarzda hisoblanadi. Boshlanish va tugatish nuqtalari oʻrtasida,<math xmlns="http://www.w3.org/1998/Math/MathML"><semantics><mrow class="MJX-TeXAtom-ORD"><mstyle displaystyle="true" scriptlevel="0"><mrow class="MJX-TeXAtom-ORD"><mrow class="MJX-TeXAtom-ORD"><mo stretchy="false"> </mo><msup><mtext> </mtext><mrow class="MJX-TeXAtom-ORD"><mo> </mo></mrow></msup><mo stretchy="false"> </mo></mrow></mrow></mstyle></mrow><annotation encoding="application/x-tex"> </annotation></semantics></math></img>Xenderson-Hasselbalx tenglamasidan olinadi va titrlash aralashmasi bufer sifatida qabul qilinadi. Henderson-Hasselbalch tenglamasida [acid] va [base] hatto dissotsilanish yoki gidrolizda ham mavjud boʻlgan molyarliklar deyiladi. Buferda,<math xmlns="http://www.w3.org/1998/Math/MathML"><semantics><mrow class="MJX-TeXAtom-ORD"><mstyle displaystyle="true" scriptlevel="0"><mrow class="MJX-TeXAtom-ORD"><mrow class="MJX-TeXAtom-ORD"><mo stretchy="false"> </mo><msup><mtext> </mtext><mrow class="MJX-TeXAtom-ORD"><mo> </mo></mrow></msup><mo stretchy="false"> </mo></mrow></mrow></mstyle></mrow><annotation encoding="application/x-tex"> </annotation></semantics></math></img>aniq hisoblash mumkin, lekin HA ning dissotsiatsiyasi, gidrolizlanishi<math xmlns="http://www.w3.org/1998/Math/MathML"><semantics><mrow class="MJX-TeXAtom-ORD"><mstyle displaystyle="true" scriptlevel="0"><mrow class="MJX-TeXAtom-ORD"><msup><mtext> </mtext><mrow class="MJX-TeXAtom-ORD"><mo> </mo></mrow></msup></mrow></mstyle></mrow><annotation encoding="application/x-tex"> </annotation></semantics></math></img>va suvning oʻz-oʻzidan ionlanishini hisobga olish kerak.[28] Toʻrtta mustaqil tenglamadan foydalanish kerak:[29]
Tenglamalarda, va mos ravishda buferda ishlatiladigan kislota (HA) va tuz (XA bu yerda X kation) mollari, eritma hajmi esa V ga teng. Olingan birinchi va ikkinchi tenglamalar uchun suvning ionlanishi va kislotaning dissotsilanishi uchun massa taʼsir qonuni qoʻllanadi. Ommaviy muvozanat uchinchi tenglamada qoʻllanadi, bu yerda yigʻindisi va mos ravishda erigan kislota va asosning mollari soniga teng bo'lishi kerak. Zaryad balansi toʻrtinchi tenglamada qoʻllanadi, bu yerda chap tomon kationlarning umumiy zaryadini, oʻng tomoni esa anionlarning umumiy zaryadini ifodalaydi: kationning molyarligi (masalan, natriy, agar buferni tayyorlashda kislotaning natriy tuzi yoki natriy gidroksid ishlatilsa).[30]
Oksidlanish-qaytarilish titrlash
[tahrir | manbasini tahrirlash]Oksidlanish-qaytaruvchi titrlash oksidlovchi va qaytaruvchi oʻrtasidagi qaytarilish-oksidlanish reaksiyasiga asoslanadi. Titrlashning soʻnggi nuqtasini aniqlash uchun odatda potansiyometr yoki oksidlanish-qaytarilish indikatori ishlatiladi, chunki tarkibiy qismlardan biri oksidlovchi modda kaliy bixromat boʻlsa, Eritmaning toʻq sariqdan yashil rangga oʻzgarishi aniq emas, shuning uchun natriy difenilamin kabi indikator ishlatiladi.[31] Oltingugurt dioksidi uchun vinolarni tahlil qilish oksidlovchi vosita sifatida yodni talab qiladi. Bunday holda, kraxmal indikator sifatida ishlatiladi; koʻk kraxmal-yod kompleksi ortiqcha yod ishtirokida hosil boʻlib, oxirgi nuqtani bildiradi.[32]
Baʼzi oksidlanish-qaytarilish titrlashlari tarkibiy qismlarning turli rangi tufayli indikatorni talab qilmaydi. Masalan, permanganometriyada ozgina xira pushti rang ortiqcha kaliy permanganatning oksidantining rangi tufayli titrlashning oqirgi nuqtasini bildiradi.[33] Yodometriyada yetarlicha katta kontsentratsiyalarda qizil-jigarrang triiodid ionining yoʻqolishi soʻnggi nuqta sifatida ishlatilishi mumkin, ammo past konsentratsiyalarda sezgirlik triiodid bilan intensiv koʻk kompleks hosil qiluvchi kraxmal indikatorini qoʻshish orqali yaxshilanadi.

Gaz fazasili titrlash
[tahrir | manbasini tahrirlash]Gaz fazasini titrlash - bu gaz fazasida, xususan, titrant sifatida ishlaydigan boshqa gazning koʻpligi bilan reaksiyaga kirishish orqali reaktiv turlarni aniqlash usullari sifatida amalga oshiriladigan titrlashlar. Bitta umumiy gaz fazali titrlashda gazsimon ozon reaksiyaga muvofiq azot oksidi bilan titrlanadi.
Reaksiya tugagandan soʻng, qolgan titrant va mahsulot miqdori aniqlanadi (masalan, Furye transformatsiyasi spektroskopiyasi orqali) (FT-IR); bu asl namunadagi analit miqdorini aniqlash uchun ishlatiladi.
Gaz fazali titrlash oddiy spektrofotometriyaga nisbatan bir qancha afzalliklarga ega. Birinchidan, oʻlchov yoʻl uzunligiga bogʻliq emas, chunki ortiqcha titrantni ham, mahsulotni ham oʻlchash uchun bir xil yoʻl uzunligi qoʻllanadi. Ikkinchidan, o'lchov Beer-Lambert qonuni bilan belgilangan analit konsentratsiyasining funksiyasi sifatida absorbansning chiziqli oʻzgarishiga bogʻliq emas. Uchinchidan, odatda analit uchun ishlatiladigan toʻlqin uzunliklarida aralashadigan turlarni oʻz ichiga olgan namunalar uchun foydalidir.[36]
Kompleksometrik titrlash
[tahrir | manbasini tahrirlash]Kompleksometrik titrlashlar analit va titrant oʻrtasida kompleks hosil boʻlishiga tayanadi. Umuman olganda, ular tahlil qiluvchi modda bilan zaif komplekslar hosil qiluvchi maxsus kompleksometrik koʻrsatkichlarni talab qiladi. Eng keng tarqalgan misol - yodometrik titrlashning sezgirligini oshirish uchun kraxmal indikatoridan foydalanish, kraxmalning yod va yodid bilan toʻq koʻk kompleksi faqat yodga qaraganda koʻproq koʻrinadi. Boshqa kompleksometrik koʻrsatkichlar - kalsiy va magniy ionlarini titrlash uchun Erioxrom qora T va eritmadagi metall ionlarini titrlash uchun ishlatiladigan xelatlashtiruvchi EDTA.[37]
Zeta potentsial titrlash
[tahrir | manbasini tahrirlash]Zeta potentsial titrlash - bu kolloidlar kabi geterogen tizimlarni tavsiflash uchun indikator bilan emas, balki zeta potentsial tomonidan nazorat qilinadigan titrlashlar hisoblanadi.[38] Foydalanishlardan biri pH ni oʻzgartirish yoki sirt faol moddasini qoʻshish orqali erishilgan sirt zaryadi nolga aylanganda izoelektrik nuqtani aniqlashdir. Yana bir foydalanish, flokulasyon yoki stabilizasyon uchun optimal dozani aniqlashdir.[39]
Tahlil
[tahrir | manbasini tahrirlash]Titrlashning oxirgi nuqtasini oʻlchash
[tahrir | manbasini tahrirlash]Yakuniy nuqtani aniqlashning turli usullari quyidagilardan iborat:[40]
- Koʻrsatkich: kimyoviy oʻzgarishlarga javoban rangini oʻzgartiradigan modda. Kislota-asosli indikatori (masalan, fenolftalein) pH ga qarab rangini oʻzgartiradi. Redoks koʻrsatkichlari ham qoʻllanadi. Titrlashning boshida bir tomchi indikator eritmasi qoʻshiladi; rang oʻzgarganda oxirgi nuqtaga erishiladi.
- Potensiometr : eritmaning elektrod potentsialini oʻlchaydigan asbob. Bular redoks titrlash uchun ishlatiladi; oxirgi nuqtaga erishilganda ishchi elektrodning salohiyati toʻsatdan oʻzgaradi.

- pH oʻlchagich : potentsial eritmada mavjud boʻlgan H+ ionining miqdoriga bogʻliq bo'lgan elektrodli potansiyometr. (Bu ion-selektiv elektrodga misol.) Eritmaning pH qiymati butun titrlash davomida indikatorga qaraganda aniqroq oʻlchanadi; oxirgi nuqtada oʻlchangan pHda keskin oʻzgarish boʻladi.
- O'tkazuvchanlik : eritmadagi ionlarni oʻlchash. Ion konsentratsiyasi titrlashda sezilarli darajada oʻzgarishi mumkin, bu esa o'tkazuvchanlikni oʻzgartiradi. (Masalan, kislota-asos titrlashda H+ va OH- ionlari neytral H2O hosil qilish uchun reaksiyaga kirishadi.) Umumiy oʻtkazuvchanlik eritmada mavjud boʻlgan barcha ionlarga bogʻliq boʻlgani uchun va barcha ionlar bir xil hissa qoʻshmaydi (harakatchanlik va ion kuchi tufayli), o'tkazuvchanlikning oʻzgarishini taxmin qilish uni oʻlchashdan ko'ra qiyinroq.
- Rang oʻzgarishi: Baʼzi reaksiyalarda eritma hech qanday qoʻshimcha indikatorsiz rangini oʻzgartiradi. Bu koʻpincha mahsulot va reaktivning turli oksidlanish darajalari turli xil ranglar hosil qilganda redoks titrlashlarida kuzatiladi.
- Choʻkma : Agar reaksiya qattiq hosil qilsa, titrlash paytida choʻkma hosil boʻladi. Klassik misol - Ag+ va Cl- oʻrtasidagi erimaydigan tuz AgCl hosil qilish reaksiyasi. Bulutli yogʻingarchilik odatda oxirgi nuqtani aniq aniqlashni qiyinlashtiradi. Kompensatsiya qilish uchun yog'ingarchilik titrlash koʻpincha "teskari" titrlash sifatida amalga oshirilishi kerak (pastga qarang).
- Izotermik titrlash kalorimetri : yakuniy nuqtani aniqlash uchun reaksiya natijasida hosil boʻlgan yoki isteʼmol qilinadigan issiqlikni oʻlchaydigan asbob. Substratlarning fermentlar bilan qanday bogʻlanishini aniqlash kabi biokimyoviy titrlashda qoʻllanadi.
- Termometrik titrimetriya : Kalorimetrik titrimetriyadan farqlanadi, chunki reaksiya issiqligi (haroratning koʻtarilishi yoki tushishi bilan ko'rsatilgan) namuna eritmasidagi analit miqdorini aniqlash uchun ishlatilmaydi. Buning oʻrniga, oxirgi nuqta harorat o'zgarishi tezligi bilan belgilanadi.
- Spektroskopiya : agar reaktiv, titrant yoki mahsulot spektri maʼlum boʻlsa, titrlash paytida eritmaning yorugʻlik yutilishini oʻlchash uchun ishlatiladi. Materialning konsentratsiyasini Pivo qonuni bilan aniqlash mumkin.
- Amperometriya : Analitning oksidlanishi yoki kamayishi natijasida titrlash reaksiyasi natijasida hosil boʻlgan oqimni oʻlchaydi. Oxirgi nuqta oqimning oʻzgarishi sifatida aniqlanadi. Bu usul galogenidlarni Ag+ bilan titrlashda boʻlgani kabi ortiqcha titrantni kamaytirish mumkin boʻlganda eng foydali hisoblanadi.
Yakuniy nuqta va ekvivalentlik nuqtasi
[tahrir | manbasini tahrirlash]Ekvivalentlik nuqtasi va oxirgi nuqta atamalari koʻpincha bir-birining oʻrnida ishlatilsada, ular har xil atamalardir. Ekvivalentlik nuqtasi reaksiyaning nazariy yakuni: qoʻshilgan titrantning hajmi, bunda titrantning mollari soni analitning mollari soniga yoki uning bir necha koʻpligiga teng boʻladi (poliprotik kislotalarda bo'lgani kabi). Yakuniy nuqta - bu aslida oʻlchanadigan narsa, yuqorida aytib oʻtilgan indikator yoki asbob tomonidan aniqlangan eritmadagi fizik oʻzgarish hisoblanadi.[41]
Titrlashning oxirgi nuqtasi va ekvivalent nuqtasi oʻrtasida biroz farq bor. Bu xato indikator xatosi deb ataladi va u noaniq. ]
Teskari titrlash
[tahrir | manbasini tahrirlash]Teskari titrlash teskari tartibda amalga oshiriladigan titrlashdir; dastlabki namunani titrlash oʻrniga eritmaga standart reaktivning maʼlum ortiqcha miqdori qoʻshiladi va ortigʻi titrlanadi. Agar teskari titrlashning oxirgi nuqtasini normal titrlashning oxirgi nuqtasidan koʻra aniqlash osonroq boʻlsa, yomgʻir reaksiyalarida boʻlgani kabi, teskari titrlash foydali boʻladi. Qayta titrlash, agar analit va titrant oʻrtasidagi reaksiya juda sekin boʻlsa yoki analit erimaydigan qattiq moddada boʻlsa ham foydalidir.[42]
Grafik usullar
[tahrir | manbasini tahrirlash]Titrlash jarayoni sof kislotadan sof asosgacha boʻlgan kompozitsiyalar bilan eritmalar hosil qiladi. Titrlash jarayonining har qanday bosqichi bilan bogʻliq pHni aniqlash monoprotik kislotalar va asoslar uchun nisbatan oddiy. Bir nechta kislota yoki asos guruhining mavjudligi bu hisob-kitoblarni murakkablashtiradi. Ekviligraf[43][44] uzoq vaqtdan beri bogʻlangan muvozanatlarning oʻzaro taʼsirini hisobga olish uchun ishlatilgan. Ushbu grafik yechim usullarini amalga oshirish oson, ammo ular kamdan-kam qoʻllanadi.
Maxsus foydalanish
[tahrir | manbasini tahrirlash]
Kislota-asosli titrlashlari
[tahrir | manbasini tahrirlash]- Biodizel yoqilgʻisi uchun: chiqindi oʻsimlik moyi (CHOʼM) partiyani qayta ishlashdan oldin zararsizlantirilishi kerak. CHOʼM ning bir qismi kislotalikni aniqlash uchun asos bilan titrlanadi, shuning uchun qolgan partiyani toʻgʻri neytrallash mumkin. Bu odatda biodizel yoqilgʻisi oʻrniga sovun hosil qilish uchun reaksiyaga kirishadigan CHO'M dan erkin yogʻ kislotalarini olib tashlaydi.[45]
- Kjeldahl usuli : namunadagi azot miqdorini oʻlchash hisoblanadi. Organik azot sulfat kislota va kaliy sulfat bilan ammiakga parchalanadi. Nihoyat, ammiak borik kislotasi va keyin natriy karbonat bilan qayta titrlanadi.[46]
- Kislota qiymati : bir gramm namunadagi kislotani toʻliq titrlash uchun zarur boʻlgan kaliy gidroksidining (KOH) milligrammdagi massasi. Masalan, erkin yogʻ kislotasi miqdorini aniqlash.
- Sovunlanish qiymati : bir gramm namunadagi yogʻ kislotasini sovunlash uchun zarur bo'lgan milligramm KOH massasi. Sovunlashtirish yogʻdagi yogʻ kislotalarining oʻrtacha zanjir uzunligini aniqlash uchun ishlatiladi.
- Ester qiymati (yoki ester indeksi): hisoblangan indeks. Ester qiymati = Sovunlanish qiymati - Kislota qiymati.
- Amin qiymati: KOH ning milligrammdagi massasi bir gramm namunadagi amin miqdoriga teng.
- Gidroksil qiymati : bir gramm namunadagi gidroksil guruhlarga mos keladigan KOH ning milligrammdagi massasi. Analit sirka angidrid yordamida atsetillanadi, keyin KOH bilan titrlanadi.
Redoks titrlashlari
[tahrir | manbasini tahrirlash]- Erigan kislorod uchun Winkler testi : Suvdagi kislorod kontsentratsiyasini aniqlash uchun ishlatiladi. Suv namunalaridagi kislorod yod hosil qilish uchun kaliy yodid bilan reaksiyaga kirishadigan marganets (II) sulfat yordamida kamayadi. Yod namunadagi kislorodga mutanosib ravishda chiqariladi, shuning uchun kislorod konsentratsiyasi kraxmal indikatori yordamida yodni tiosulfat bilan redoks titrlash bilan aniqlanadi.[47]
- C vitamini : Askorbin kislotasi sifatida ham tanilgan, vitamin C kuchli qaytaruvchi vositadir. Uning kontsentratsiyasini koʻk boʻyoq Dixlorofenolindofenol (DCPIP) bilan titrlanganda osongina aniqlash mumkin, bu vitamin bilan qaytarilganda rangsiz boʻladi.[48]
- Benedikt reaktivi : Siydikdagi ortiqcha glyukoza bemorda diabet kasalligini koʻrsatishi mumkin. Benedikt usuli - tayyorlangan reagent yordamida siydikdagi glyukoza miqdorini aniqlashning anʼanaviy usuli. Ushbu turdagi titrlash paytida glyukoza kup ionlarini kaliy tiosiyanat bilan reaksiyaga kirishib, oq cho'kma hosil qilish uchun piroz ionlariga kamaytiradi, bu oxirgi nuqtani koʻrsatadi.[49]
- Brom soni : Analitning toʻyinmaganlik oʻlchovi, 100 gramm namuna tomonidan soʻrilgan brom milligramlarida ifodalangan.
- Yod soni : Analitning toʻyinmaganlik oʻlchovi, 100 gramm namuna soʻrilgan yod grammida ifodalangan
- Karl Fisher titrlash : moddadagi suvning iz miqdorini tahlil qilish uchun potentsiometrik usul. Namuna metanolda eritiladi va Karl Fisher reaktivi bilan titrlanadi. Reaktiv tarkibida suv bilan mutanosib ravishda reaksiyaga kirishadigan yod mavjud. Shunday qilib, suv miqdori ortiqcha yodning elektr potentsialini kuzatish orqali aniqlanishi mumkin.[50]
Yana qarang
[tahrir | manbasini tahrirlash]- Birlamchi standartlar - bu titrlash uchun standart eritmalar tayyorlash uchun ishlatiladigan izchil va ishonchli xususiyatlarga ega birikmalar.
Manbalar
[tahrir | manbasini tahrirlash]- ↑ Whitney, W.D.; Smith, B.E. (1911). "Titrimetry". The Century Dictionary and Cyclopedia. The Century Co.. p. 6504.
- ↑ Compendium for Basal Practice in Biochemistry. Aarhus University, 2008.
- ↑ „Titrand“. Science & Technology Dictionary. McGraw-Hill. Qaraldi: 30-sentabr 2011-yil.
- ↑ Ortolang: "titre" (in French): "4. a) 1543 tiltre « proportion d'or ou d'argent dans les monnaies, dans les ouvrages d'or et d'argent » " (tiltre: proportion of gold or silver in monies, in works of gold or silver)
- ↑ „Etymology On Line: titrate“.
- ↑ „WordReference: titre and titer“.
- ↑ Gay-Lussac (1828). „Essai des potasses du commerce“. Annales de Chimie et de Physique. 2nd series (fransuzcha). 39-jild. 337–368-bet.
{{cite magazine}}: Unknown parameter|trans_title=ignored (|trans-title=suggested) (yordam) In footnote (1) of p. 340, Gay-Lussac first uses titre as a verb: "Il leur serait plus facile de titrer l'acide sulfurique normal au moyen du carbonate de soude ou de potasse pur; … " ([In determining the concentration of sulfuric acid] it would be easier for them to titrate normal sulfuric acid by means of pure sodium or potassium carbonate; …) - ↑ Szabadváry, Ferenc. History of Analytical Chemistry. Taylor & Francis, 1993 — 208–209-bet. ISBN 2-88124-569-2.
- ↑ Descroizilles (1795). „Description et usages du Berthollimêtre, …“. Journal des Arts et Manufactures (fransuzcha). 1-jild. 256–276-bet.
{{cite magazine}}: Unknown parameter|trans_title=ignored (|trans-title=suggested) (yordam) - ↑ Wisniak, Jaime (2014). „François Antoine Henri Descroizilles“. Revista CENIC Ciencias Químicas. 45-jild, № 1. 184–193-bet.
- ↑ Gay-Lussac (1824). „Instruction sur l'essai du chlorure de chaux“. Annales de chimie et de physique. 2nd series (fransuzcha). 26-jild. 162–175-bet.
{{cite magazine}}: Unknown parameter|trans_title=ignored (|trans-title=suggested) (yordam) On pp. 170–171, Gay-Lussac describes various figures that appear in a plate (illustration) that accompanies the article. From p. 170: " F, petite mesure ou pipette de 2 ½ centimètres cubes, … " (F, small measure or "pipette" of 2 ½ cc., …) From p. 171: " I, burette destinée à mesurer la teinture d'épreuve: … " (I, "burette" intended to measure the test dye: …) - ↑ Henry, O. (1845). „Nouvelles expériences sur l'essai des potasses du commerce et appareil dit potassimètre pour l'effectuer“. Journale de Pharmacie et de Chimie. 3rd series (fransuzcha). 7-jild. 214–222-bet.
{{cite magazine}}: Unknown parameter|trans_title=ignored (|trans-title=suggested) (yordam) A sketch of Henry's burette appears on p. 218. - ↑ Szabadváry, Ferenc (1986). „The history of chemical laboratory equipment“. Periodica Polytechnica Chemical Engineering. 30-jild, № 1–2. 77–95-bet. See p. 87.
- ↑ Szabadváry, Ferenc. History of Analytical Chemistry. Oxford, England: Permagon Press, 1966 — 237-bet. ISBN 9781483157122.
- ↑ Christophe, R. (1971). „L'analyse volumétrique de 1790 à 1860. Caractéristiques et importance industrielle. Evolution des instruments“. Revue d'histoire des sciences (fransuzcha). 24-jild, № 1. 25–44-bet. doi:10.3406/rhs.1971.3172.
{{cite magazine}}: Unknown parameter|trans_title=ignored (|trans-title=suggested) (yordam) From p. 38: " … il préfigure bien ses descendants actuelles … " (… it [i.e., Henry's burette] foreshadows well its modern descendants …) - ↑ Rosenfeld, L.. Four Centuries of Clinical Chemistry. CRC Press, 1999 — 72–75-bet. ISBN 90-5699-645-2.
- ↑ Mohr, Karl Friedrich. Lehrbuch der chemisch-analytischen Titrirmethode …, part 1 (de). Braunschweig, (Germany): Friederich Vieweg und Sohn, 1855 — 2–20-bet. Page 3 shows Mohr's burette; page 12 shows a burette with a glass stopcock (Glasshahn).
- ↑ da Nobrega Gaiao, E., Martins, V. L., da Silva Lyra, W., de Almeida, L. F., da Silva, E. C., & Araújo, M. C. U. (2006). Digital image-based titrations. Analytica Chimica Acta, 570(2), 283-290. doi: 10.1016/j.aca.2006.04.048. https://www.academia.edu/download/53035363/4_-_Digital_image-based_titrations_2006.pdf[sayt ishlamaydi]
- ↑ Matar, S.. Chemistry of Petrochemical Processes, 2, Gulf Professional Publishing, 2001. ISBN 0-88415-315-0.
- ↑ Verma, Dr. N.K.. Comprehensive Chemistry XI. New Delhi: Laxmi Publications — 642–645-bet. ISBN 81-7008-596-9.
- ↑ Patnaik, P.. Dean's Analytical Chemistry Handbook, 2, McGraw-Hill Prof Med/Tech, 2004 — 2.11–2.16-bet. ISBN 0-07-141060-0.
- ↑ Walther, J.V.. Essentials of Geochemistry. Jones & Bartlett Learning, 2005 — 515–520-bet. ISBN 0-7637-2642-7.
- ↑ Reger, D.L.. Chemistry: Principles and Practice, 3, Cengage Learning, 2009 — 684–693-bet. ISBN 978-0-534-42012-3.
- ↑ Bewick, S.. CK12 Chemistry. CK-12 Foundation, 2009 — 794–797-bet.
- ↑ „pH measurements with indicators“. 2021-yil 28-aprelda asl nusxadan arxivlangan. Qaraldi: 2022-yil 16-iyun.
- ↑ „Titrating Soluble RM, R2NM and ROM Reagents“.
- ↑ „Methods for Standardizing Alkyllithium Reagents (literature through 2006)“. Qaraldi: 2014-yil 4-iyun.
- ↑ Harris, Daniel C.. Quantitative Chemical Analysis, Seventh, Freeman and Company, 2007. ISBN 978-0-7167-7041-1.
- ↑ Skoog, D.A.. Analytical Chemistry: An Introduction, seventh edition. Emily Barrosse, 2000 — 265-305-bet. ISBN 0-03-020293-0.
- ↑ Henry, N.. The Henderson-Hasselbalch Equation: Its History and Limitations. Journal of Chermical Education, 2001 — 1499–1503-bet.
- ↑ Vogel, A.I.. Vogel's textbook of quantitative chemical analysis, 6, Prentice Hall, 2000 — 423-bet. ISBN 0-582-22628-7.
- ↑ Amerine, M.A.. Table wines: the technology of their production, 2, University of California Press, 1970 — 751–753-bet. ISBN 0-520-01657-2.
- ↑ German Chemical Society. Division of Analytical Chemistry. Fresenius' Journal of Analytical Chemistry (de). University of Michigan: J.F. Bergmann, 1959 — 1-bet.
- ↑ Hänsch, T.W.. Metrology and Fundamental Constants. IOS Press, 2007 — 568-bet. ISBN 978-1-58603-784-0.
- ↑ „Gas phase titration“. Bureau International des Poids et Mesures. Qaraldi: 29-sentabr 2001-yil.
- ↑ DeMore, W.B.; M. Patapoff (September 1976). „Comparison of Ozone Determinations by Ultraviolet Photometry and Gas-Phase Titration“. Environmental Science & Technology. 10-jild, № 9. 897–899-bet. Bibcode:1976EnST...10..897D. doi:10.1021/es60120a012.
- ↑ Khopkar, S.M.. Basic Concepts of Analytical Chemistry, 2, New Age International, 1998 — 63–76-bet. ISBN 81-224-1159-2.
- ↑ Somasundaran, P. (2006). „Calculation of Zeta-Potentials from Electrokinetic Data“. Encyclopedia of Surface and Colloid Science. 2-jild (2-nashr). CRC Press. 1097-bet. ISBN 0-8493-9607-7.
- ↑ Dukhin, A. S. and Goetz, P. J. Characterization of liquids, nano- and micro- particulates and porous bodies using Ultrasound, Elsevier, 2017 ISBN 978-0-444-63908-0
- ↑ "Titration". Science & Technology Encyclopedia. McGraw-Hill. http://www.answers.com/topic/titration. Qaraldi: 30 September 2011.
- ↑ Harris, D.C.. Quantitative Chemical Analysis, 6, Macmillan, 2003 — 129-bet. ISBN 0-7167-4464-3.
- ↑ Kenkel, J.. Analytical Chemistry for Technicians, 3, CRC Press, 2003 — 108–109-bet.
- ↑ Freiser, H.. Ionic Equilibria in Analytical Chemistry. Kreiger, 1963. ISBN 0-88275-955-8.
- ↑ Hatfield. „The Equligraph: Revisiting an old tool“. tahosa.us (2015).
- ↑ Purcella, G.. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, 2007 — 81–96-bet. ISBN 978-1-56975-624-9.
- ↑ Remington: the science and practice of pharmacy, 21, Lippincott Williams & Wilkins, 2005 — 501-bet. ISBN 0-7817-4673-6.
- ↑ Spellman, F.R.. Handbook of Water and Wastewater Treatment Plant Operations, 2, CRC Press, 2009 — 545-bet. ISBN 978-1-4200-7530-4.
- ↑ Biology. London: Taylor & Francis, 1967 — 52-bet.
- ↑ Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education, 2007 — 149-bet. ISBN 978-0-07-061767-4.
- ↑ Jackson, M.L.. Soil Chemical Analysis: Advanced Course. UW-Madison Libraries Parallel Press, 2005 — 305–309-bet. ISBN 1-893311-47-3.
Havolalar
[tahrir | manbasini tahrirlash]- Wikihow: Titrlashni amalga oshirish
- Titrlash bo'yicha interaktiv qo'llanma
- Ilmiy yordam: titrlashning oddiy tushuntirishi, jumladan hisoblash misollari (Wayback Machine saytida 2011-12-06 sanasida arxivlangan)
- Titrlash bepul dasturi - har qanday pH va hajm egri chizig'ini simulyatsiya qilish, tarqatish diagrammasi va haqiqiy ma'lumotlarni tahlil qilish
- Kislota-asos masalalarini echishning grafik usuli, shu jumladan titrlash
- Umumiy kislota-asos muammolari uchun grafik va raqamli hal qiluvchi - Telefon va planshetlar uchun dasturiy ta'minot

![{\displaystyle {\ce {[H+]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)

![{\displaystyle [{\ce {H+}}][{\ce {OH-}}]=10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e64e80f918a64e1000aa161c7f047b046ed20149)
![{\displaystyle [{\ce {H+}}]=K_{a}{\ce {{\frac {[HA]}{[A^{-}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d401c8135577b043dbcb08c4ebc4b3340ce8430)
![{\displaystyle [{\ce {HA}}]+[{\ce {A-}}]={\frac {(n_{{\ce {A}}}+n_{{\ce {B}}})}{V}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1515a6091588b1b119a198b28d6d1908decca748)
![{\displaystyle [{\ce {H+}}]+{\frac {n_{{\ce {B}}}}{V}}=[{\ce {A-}}]+[{\ce {OH-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60c7344bbd50c9a75dcb598142e874aa39349a93)


![{\displaystyle V[{\ce {HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2580ec25274d91056971bfecc5c37718436f9c1)
![{\displaystyle V[{\ce {A-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45100d92fd8e282f61ee30e05034cbe2853523dd)
