Proteinlar

Oqsillar, proteinlar — molekulalari aminokislotalar qoldigʻidan tuzilgan (bir-biri bilan, asosan, amin va karboksil guruxlari orqali birikkan) moddalar. Suvda va tuzli eritmalarda eruvchanligiga koʻra, proteinlarga tegishli oqsillar 7 ga boʻlinadi: albulinlar, globulinlar, glutaminlar, gistonlar, prolaminlar, protaminlar, skleroproteinlar. Pepsin, tripsin, ximotripsin, papain kabi proteolitik fermentlar ham proteinlarga taalluqli. Proteinlar termini, koʻpincha, oqsillar sinonimi sifatida qoʻllanadi.[1] Hamma tirik mavjudotlar tarkibiga kiradigan murakkab, azot tutuvchi organik moddalar hosoblanadi. Oqsil hayot faoliyatida muhim ahamiyatga ega. Hujayra tarkibida bir necha ming xil oqsil mavjud boʻlib, ularning har biri maʼlum bir vazifani bajaradi. Shuning uchun ular proteinlar (yun. protos — birinchi, eng muhim) deb ataladi. Oqsil hujayra quruq vaznining 3/4 qismini tashkil etadi. Maʼlumki, hamma organizmlarning oqsillari, ularning har xil biologik faolligidan katʼi nazar, bir xil 20 ta standart aminokislotadan tashkil topgan boʻlib, bu kislotalar alohida hech qanday biologik faollikka ega emas. Oqsilning birbiridan kimyoviy farqi, ulardagi aminokislotalarning ketma-ketligiga bogʻliq. Aminokislotalar oqsil tuzilmasining alifbosi boʻlib, ularni turli tartibda biriktirib, cheksiz sondagi ketma-ketliklarni, yaʼni cheksiz miqdordagi har xil oqsillarni olish mumkin. Mas, har bir tur organizmda bir necha ming xil Oqsil. mavjud boʻlib, ular turlarining soni 10 mln. atrofida. Matematik izlanishlar shuni koʻrsatadiki, 20 ta aminokislotadan hosil boʻlishi mumkin boʻlgan Oqsil. izomerlarining ogʻirligi Yer shari ogʻirligidan ogʻirroq boʻlar ekan. Oqsillar makromolekulalar boʻlib, ularning mol. Majmuasi bir necha mingdan bir necha mlnga teng. Oqsillar molekulasining qurilish ashyosi sifatida aminokislotalar xizmat qiladi. Aaminokislotaning bir uglerod atomiga (a-uglerod atomi) aminoguruh va karboksil guruh birikadi. Oqsillarda 20 turdagi aminokislota uchraydi, ular bir-biridan R-guruhi bilan farq qiladi, u gidrofil yoki gidrofob, asosli, kislotali yoki neytral boʻlishi mumkin. Oqsillardagi aminokislotalar bir-biri bilan peptid bogʻlari, yaʼni amina bogʻlari bilan birikkan, bu bogʻ bir aminokislota a-karboksil qoldigʻining ikkinchi aminokislota a-aminoguruxli qoldigʻi bilan bogʻlanishi hisobiga hosil boʻladi. Shu koʻrinishda tuzilgan polimerlar peptidlar deb ataladi, di-, tri-, tetra- va boshqalar deb nomlangan old qoʻshimchalar, molekula tarkibidagi aminokislota qoldiklari soniga bogʻliq, masalan dipeptidda 2 ta qoldiq, tripeptidda — uchta qoldiq va boshqa uncha katta boʻlmagan aminopeptidlardan farqli oʻlaroq, polipeptidlar 20 yoki undan ortiq (oqsil tabiatiga koʻra, taxminan 50 tadan 2500 tagacha) aminokislota qoldiqlari tutadi. Oqsillar ketma-ket joylashgan aminokislota qoldiqlari, uzun zanjirni yoki oqsillarning birlamchi tuzilmasini tashkil etadi. Oʻz navbatida, oqsilning har xil joyida joylashgan aminokislota qoldiqlari tarkibidagi kimyoviy moddalar oʻzaro har xil boglar bilan bogʻlanishi natijasida oqsilning murakkab ikkilamchi, uchlamchi va toʻrtlamchi tuzilmalari hosil boʻladi. Yuqorituzilishdagi tuzilmalar fizik va kimyoviy omillar (yuqori harorat, kislota, ishqor va boshqalar) taʼsirida quyi tuzilishdagi shakllarga qaytadi (bu hodisa oqsil denaturatsiyasi deb ataladi), natijada ular oʻz biologik faolligini yoʻqotadi. Ammo ayrim hollarda tashqi taʼsir yoʻqotilsa oqsil. yuqori koʻrinishdagi shakllariga qaytadi.
Oqsil tuzilishi va vazifalari boʻyicha xilma-xil. Tuzilishiga koʻra, 2 katta guruhga boʻlish mumkin: globulyar va fibrillyar. Globulyar oqsillar asosan, sferik yoki ellips shaklida boʻlib, ular tarkibiga boshqa guruh moddalar ham qoʻshilgan (prostetik guruh). Masalan, gemoglobin globin va gemning qoʻshilmasidan hosil boʻlgan, shuning uchun uni yana gemoproteid deb ham atashadi. Lipid tutuvchi oqsil lipoproteidlar, uglevod tutuvchilar — glikoproteidlar, metall tutuvchilar — metall proteidlar deyiladi.
Fibrillyar oqsil — bir yoki bir necha polipeptid zanjirdan tashkil topgan moddalar hisoblanadi. Ular uzun ip koʻrinishida boʻladi. Biriktiruvchi toʻqima (aktin, miozin, kollagen), soch, teri (a-keratin) oqsillari bunga misol boʻla oladi. Fibrillyar oqsillar, asosan, qurilish ashyosi yoki himoya vazifasini bajaradi. Oqsillarning biologik vazifalari boʻyicha quyidagi tasnifi mavjud: fermentlar (tripsin, ribonukleaza), tashuvchi oqsillar (gemoglobin, zardob albumini, mioglobin), oziq-ovqat va zaxira Oqsillari (tuxum albumini, sutdagi kazein, ferritin), qisqaruvchi va harakat Oqsillari (aktin, miozin), tuzilma Oqsillari (kollagen, proteoglikanlar, kreatin), himoya Oqsillari (antitelolar, fibrinogen, trombin, ilon zahari, boʻgʻma qoʻzgʻatuvchisining toksini), nazorat qiluvchi oqsillar (insulin, kortikotropin, oʻsish gormoni) va boshqalar.
Oqsil ajratib olish ulardagi aminokislota qoldiklarini aniqlashda kimyo va molekulyar biologiya fanlarining usullaridan (dializ, gelfiltratsiya, elektroforez, xromatografiya, sekve-natsiya va boshqalar) foydalaniladi.
Oqsillar (oqsillar, polipeptidlar[2]) — yuqori molekulyar ogʻirlik organik moddalar, alfa aminokislotalar dan iborat, bir-biriga bogʻlangan zanjir peptid bogʻ. Tirik organizmlarda oqsillarning aminokislotalar tarkibi genetik kod bilan aniqlanadi, sintez jarayonida aksariyat hollarda 20 ta standart aminokislotalar[3]. Ularning koʻp kombinatsiyasi oqsil molekulalarining turli xil xususiyatlarini aniqlaydi. Bundan tashqari, oqsil tarkibidagi aminokislota qoldiqlari koʻpincha tarjimadan keyingi oʻzgarishlarga duch keladi, bu protein oʻz vazifasini bajara boshlagunga qadar ham, hujayradagi „ish“ paytida ham sodir boʻlishi mumkin. Koʻpincha tirik organizmlarda turli xil oqsillarning bir nechta molekulalari murakkab komplekslarni hosil qiladi, masalan, fotosintetik kompleks va boshqa komplekslar. Yuqori darajada tozalangan oqsillar past haroratlarda kristallar hosil qiladi, ular bu oqsillarning fazoviy tuzilmalarini oʻrganish uchun ishlatiladi. Tirik organizmlarning hujayralaridagi oqsillarning vazifalari funksiyalariga qaraganda ancha xilma-xildir boshqa biopolimerlar — polisaxaridlarlar va deoksiribonuklein kislotasi(DNK). Shunday qilib, oqsillar immunitet (biologiya)da asosiy rol oʻynaydi, ular transport funktsiyasini bajaradi (masalan, gemoglobin, qondagi gazlarni tashish va albumin, yogʻlarni tashish, saqlash (masalan, kazein sut). DNK polimeraza va RNK polimeraza matritsa reaktsiyalarida ishtirok etadi, strukturaviy (masalan, soch va tirnoqlar oqsildan keratin, kollagen va elastin birlashtiruvchi toʻqima biriktiruvchi toʻqimaning muhim tarkibiy qismidir tubulin mikrotubulalar hosil qiladi, retseptor hujayra signalizatsiya tizimlarida funktsiyasini bajaradi (masalan, oqsil rodopsin, zarur vizual retseptorlarning ishlashi va fotonlar yorugʻlik taʼsiriga javoban nerv impulsi shakllanishini taʼminlash uchun). Bundan tashqari, unchalik ahamiyatli boʻlmagan bir nechta funktsiyalarni ajratib koʻrsatish mumkin, masalan, energiya funktsiyasi charchaganlik bilan va zaharlarning funktsiyasi (zaharli oqsillar).
Proteinlar hayvonlar va odamlarga (asosiy manbalar: goʻsht, parranda goʻshti, baliq, sut, yongʻoq, dukkaklilar, don; ozroq: sabzavot, meva, rezavorlar va qoʻziqorinlar), chunki ularning tanasi barcha muhim aminokislotalarni sintez qila olmaydi va baʼzilari proteinli ovqatlardan kelib chiqishi kerak. hazm qilish jarayonida fermentlar isteʼmol qilingan oqsillarni aminokislotalarga parchalaydi, ular organizmning oʻz oqsillarini biosintezi uchun ishlatiladi yoki keyinchalik [[energiya] hosil qilish uchun parchalanadi. Proteinning aminokislotalar ketma-ketligini — insulina — ketma-ketlik usuli bilan birinchi marta aniqlash uchun Fridrix Sanger Kimyo boʻyicha Nobel mukofoti bilan taqdirlandi.1958 yilda u. Gemoglobina va miyoglobina oqsillarining dastlabki uch oʻlchamli tuzilmalari Rentgen nurlari diffraksiyasi bilan aniqlangan, Perutz Maks Ferdinand va Kendrew Jon Cowdery 1950-yillarning oxirida[4][5], buning uchun ular 1962 yilda kimyo boʻyicha Nobel mukofotini olishgan.
Oʻrganish tarixi
[tahrir | manbasini tahrirlash]
Protein birinchi marta Glyuten shaklida 1728-yilda italyan Jacopo Bartolomeo Beccari tomonidan bugʻdoy unidan olingan. Oqsillar XVIII asrda fransuz kimyogari Antuan de Furkroy va boshqa olimlarning faoliyati natijasida biologik molekulalarning alohida sinfi sifatida aniqlangan. bunda oqsillarning xossasi qayd etilgan koagulyatsiya (dispers sistema) oqsillarning denaturatsiyasi issiqlik yoki kislota taʼsirida. oʻsha paytda albumin („tuxum oqi“), fibrin (qon oqsili) va dondan bugʻdoy kleykovina kabi oqsillar oʻrganilgan. 19-asr boshlarida oqsillarning elementar tarkibi toʻgʻrisida baʼzi maʼlumotlar allaqachon olingan edi, maʼlumki, oqsillar gidrolizlanishi jarayonida aminokislotalar hosil boʻladi. Ushbu aminokislotalarning baʼzilari (masalan, glisin va leysin) allaqachon tavsiflangan. Gollandiyalik kimyogari Mulder Gerrit Yan oqsillarning kimyoviy tarkibi tahliliga asoslanib, deyarli barcha oqsillar oʻxshash empirik formulaga ega degan fikirni ilgari surdi. 1836-yilda Mulder oqsillarning kimyoviy tuzilishining birinchi modelini taklif qildi. Uglevodorod radikali nazariyasiga asoslanib, bir qancha takomillashtirishlardan soʻng u oqsilning minimal struktura birligi quyidagi tarkibga ega degan xulosaga keldi: C40H62< /sub>N10O12.
U bu birlikni „oqsil“ (Pr) (qadimgi yunoncha: protos - birinchi, asosiy dan), nazariyani esa — „oqsil nazariyasi“[6]. Mulderning gʻoyalariga koʻra, har bir oqsil bir necha oqsil birliklari, oltingugurt va fosfora dan iborat. Misol uchun, u fibrin formulasini 10PrSP sifatida yozishni taklif qildi. Mulder, shuningdek, oqsillarni yoʻq qilish mahsulotlarini — aminokislotalarni oʻrgandi va ulardan biri (leytsina) uchun kichik xatolik bilan molekulyar ogʻirlikni aniqladi — 131 atom massa birligi. Proteinlar haqidagi yangi maʼlumotlar toʻplanganligi sababli, oqsil nazariyasi tanqid qilina boshladi, ammo shunga qaramay, 1850-yillarning oxirigacha u hali ham umumiy qabul qilingan deb hisoblanardi. 19-asrning oxiriga kelib, oqsillarni tashkil etuvchi aminokislotalarning aksariyati oʻrganildi. 1880-yillarning oxirida rus olimi Danilevskiy Aleksandr Yakovlevichoqsil molekulasida peptid guruhlari (CO-NH) mavjudligini qayd etdi[7][8]. 1894-yilda nemis fiziologi Kossel Albrecht aminokislotalar oqsillarning asosiy tuzilish elementlari boʻlgan nazariyani ilgari surdi[9]. 20-asr boshlarida nemis kimyogari Fisher Hermann Emil oqsillar peptid bogʻlari bilan bogʻlangan aminokislotalar qoldiqlaridan iborat ekanligini tajriba yoʻli bilan isbotladi. Shuningdek, u oqsilning aminokislotalar ketma-ketligini birinchi tahlilini oʻtkazdi va proteoliz hodisasini tushuntirdi. Ammo oqsillarning organizmlardagi markaziy roli 1926 — yilda amerikalik kimyogar Sumner Jeyms Betcheller (keyinchalik kimyo boʻyicha Nobel mukofoti sovrindori) fermenti reaza ekanligini koʻrsatmaguniga qadar tan olinmagan oqsil[10].Sof oqsillarni ajratib olish qiyinligi ularni oʻrganishni qiyinlashtirdi. Shuning uchun birinchi tadqiqotlar katta miqdorda oson tozalanishi mumkin boʻlgan polipeptidlar, yaʼni qon oqsillari, tovuq tuxumlari, turli xil toksinlarlar, shuningdek, soʻyishdan keyin ajralib chiqadigan ovqat hazm qilish metabolik fermentlar yordamida amalga oshirildi. 1950-yillarning oxirida Armor Hot Dog kompaniyasi bir kilogramm sigir oshqozon osti bezi ribonukleaza A ni tozalashga muvaffaq boʻldi, bu koʻplab tadqiqotlar uchun eksperimental mavzuga aylandi. Oqsillarning ikkilamchi tuzilishi aminokislotalar qoldiqlari oʻrtasida vodorod bogʻlari hosil boʻlishi natijasi degan fikrni 1933-yilda Uilyam Astberi ilgari surgan, lekin Pauling Linus Karl oqsillarning ikkilamchi tuzilishini muvaffaqiyatli bashorat qilgan birinchi olim hisoblanadi. Keyinchalik Valter Kauzman Linnerström-Lang Kay Ulrik asarlari asosida uchlamchi tuzilish oqsillari va bu jarayondagi roli gidrofobik oʻzaro taʼsirlar. 1940-yillarning oxiri va 1950-yillarning boshida Fridrick Sanger sequencing proteins usulini ishlab chiqdi va uning yordamida insulinning ikkita zanjirining aminokislotalar ketma-ketligini aniqladi. 1955 yil [11][12][13], oqsillar aminokislotalarning chiziqli polimerlari ekanligini va shoxlangan emasligini (masalan, ba'zi shakarlar zanjirlar, kolloidlar yoki siklollar ekanligini ko'rsatadi. Aminokislotalar ketma-ketligi Sovet/Rossiya olimlari tomonidan aniqlangan birinchi oqsil 1972-yil aspartat aminotransferaza[14][15]. Rentgen nurlari diffraktsiyasi orqali olingan oqsillarning birinchi fazoviy tuzilmalari 1950-yillarning oxiri va 1960-yillarning boshlarida maʼlum boʻlgan va tuzilmalar yadro magnit rezonansi yordamida kashf etilgan 1980- 2012-yillarda Protein maʼlumotlar banki taxminan 87 000 protein tuzilmasini oʻz ichiga olgan[16].XXI asrda oqsillarni oʻrganish sifat jihatidan yangi bosqichga koʻtarildi, bunda nafaqat alohida tozalangan oqsillar, balki bir vaqtning oʻzida miqdori va tajribadan keyingi modifikatsiyalar oʻrganiladi. Alohida hujayralar, toʻqimalar yoki butun organizmlarning koʻp miqdordagi oqsillari. Biokimyoning bu sohasi proteomika deb ataladi. Bioinformatika usullaridan foydalanib, nafaqat rentgen nurlanish tahlili maʼlumotlarini qayta ishlash, balki oqsilning aminokislotalar ketma-ketligi asosida tuzilishini bashorat qilish ham mumkin boʻldi. Hozirgi vaqtda krioelektron mikroskopiya yirik oqsil komplekslari va oqsillar domenlari fazoviy tuzilmalarini kompyuter dasturlari yordamida bashorat qilish atom aniqligiga yaqinlashmoqda[17].
Xususiyatlar
[tahrir | manbasini tahrirlash]Hajmi

Oqsilning hajmini aminokislotalar qoldiqlari sonida yoki atom massa birligi (dalton) molekulyar massa bilan oʻlchash mumkin, lekin molekula nisbatan katta boʻlganligi uchun uning massasi oqsil uning hosila birliklarida, kilodaltonlarda (kDa) ifodalanadi. Xamirturush oqsillari oʻrtacha 466 ta aminokislota qoldigʻidan iborat boʻlib, molekulyar ogʻirligi 53 kDa ni tashkil qiladi. Hozirda maʼlum boʻlgan eng yirik oqsil titin sarkomerlars mushaklarlarning tarkibiy qismidir; uning turli xil variantlari (izoformalari) molekulyar ogʻirligi 3000 dan 3700 kDa gacha boʻlgan oraliqda oʻzgarib turadi. Inson titinining soleus (lotincha: soleus) 38 138 ta aminokislotadan iborat[18].Oqsillarning molekulyar ogʻirligini aniqlash uchun oʻlchamni istisno qilish xromatografiyasi, poliakrilamid gel elektroforezi, mass-spektrometrik tahlil, choʻkish tahlili va boshqalar.
Fizik-kimyoviy xossalari
[tahrir | manbasini tahrirlash]Amfoterlik oqsillar amfoterlik xususiyatiga ega, yaʼni sharoitga qarab ular kislota va asosiy xossalarini namoyon qiladi. Proteinlar suvli eritmada ionlanishlanishga qodir boʻlgan bir necha turdagi kimyoviy guruhlarni oʻz ichiga oladi: karboksil guruhi kislotali aminokislotalarning yon zanjirlari aspartik kislota va glutamik kislotalar va asosiy aminokislotalarning yon zanjirlarining azot oʻz ichiga olgan guruhlari (birinchi navbatda e-aminokislotalar lizina va amidin qoldigʻi CNH(NH2) ) arginina, biroz kamroq darajada — imidazol qoldigʻi histidina. Har bir oqsil izoelektrik nuqta (ph) bilan tavsiflanadi — muhitning kislotaliligi vodorod indeksi (pH), bunda berilgan molekulalarning umumiy elektr zaryadi oqsil nolga teng va shunga mos ravishda ular elektr maydonida harakat qilmaydi (masalan, elektroforeze paytida). Izoelektrik nuqtada oqsilning hidratsiyasi va eruvchanligi minimaldir ph qiymati oqsildagi kislotali va asosli aminokislotalar qoldiqlarining nisbatiga bogʻliq: koʻp kislotali aminokislota qoldiqlari boʻlgan oqsillar uchun izoelektrik nuqtalar kislotali mintaqada yotadi (bunday oqsillar kislotali deb ataladi), koʻproq asosiy qoldiqlarni oʻz ichiga olgan oqsillar uchun, ishqoriy mintaqada (asosiy oqsillar). Berilgan oqsilning ph qiymati ion kuchi va u joylashgan bufer eritmasi turiga qarab ham oʻzgarishi mumkin, chunki neytral tuzlar darajaga taʼsir qiladi oqsilning kimyoviy guruhlarini ionlashtirish proteinning ph ni, masalan, Kislota asosida titrlash egri chizigʻdan yoki izoelektrik fokuslash yordamida aniqlash mumkin[19].Umuman olganda, oqsilning pI koʻrsatkichi u bajaradigan funktsiyaga bogʻliq: koʻpchilik umurtqali toʻqimalar oqsillarining izoelektrik nuqtasi 5,5 dan 7,0 gacha, lekin baʼzi hollarda qiymatlar ekstremal mintaqalarda boʻladi: masalan, pepsina uchun — kuchli kislotali meʼda shirasining proteolitik fermenti pI ~ 1[20] va salmina uchun — oqsil-protamina sut yuqori arginin miqdori bilan ajralib turadigan qizil ikra, — pI ~ 12. Fosfatlar bilan Elektromagnit oʻzaro taʼsir tufayli nuklein kislotalar bilan bogʻlangan oqsillar. Fosfat guruhlari, koʻpincha asosiy oqsillardir. Bunday oqsillarga misol qilib gistonlar va protaminlarni keltirish mumkin. Oqsillar ham gidrofil]va hidrofobiklarga boʻlinadi. Gidrofillarga aksariyat oqsillar sitoplazma, yadrolari va hujayralararo modda, jumladan, erimaydigan keratin va fibroin kiradi. Gidrofobiklarga hujayra membranalari tashkil etuvchi oqsillarning aksariyati, — gidrofobik lipidlar membranalari bilan oʻzaro taʼsir qiluvchi integral membrana oqsillari[21] (bu oqsillar uchun qoida tariqasida gidrofil joylar ham mavjud).
Denaturatsiya
[tahrir | manbasini tahrirlash]
Oqsilning denaturatsiyasi uning biologik faolligi yoki fizik-kimyoviy xossalarining toʻrtlamchi, uchlamchi yoki ikkilamchi tuzilma yoʻqolishi bilan bogʻliq har qanday oʻzgarishdir (qarang. „Oqsil tuzilishi“ boʻlimi) qoida tariqasida, oqsillar organizmda normal faoliyat koʻrsatadigan sharoitlarda (harorat, pH, bosim, infraqizil nurlanish va boshqalar) ancha barqarordir[10]. Bu sharoitlarning keskin oʻzgarishi oqsil denatüratsiyasiga olib keladi. Denaturatsiya qiluvchi moddaning tabiatiga koʻra mexanik (kuchli aralashtirish yoki chayqatish), fizik (isitish, sovutish, nurlanish, ultratovush bilan ishlov berish) va kimyoviy (kislotalar va ishqorlar, sirt faol moddalar, karbamid) denaturatsiya[19]. Protein denaturatsiyasi toʻliq yoki qisman, qaytariladigan yoki qaytarilmas boʻlishi mumkin. Kundalik hayotda qaytarib boʻlmaydigan oqsil denatüratsiyasining eng mashhur hodisasi tovuq tuxumining tayyorlanishi boʻlib, u yuqori harorat taʼsirida suvda eriydigan shaffof oqsil ovalbumin zich, erimaydigan va shaffof boʻlib qoladi. Denaturatsiya baʼzi hollarda suvda eruvchan oqsillarni ammiak tuzlari yordamida choʻktirishda (tuzlash usuli) kabi teskari boʻladi va bu usul ularni tozalash usuli sifatida ishlatiladi[22].
Tuzilishi
[tahrir | manbasini tahrirlash]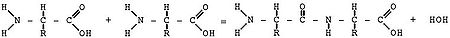
Protein molekulalari chiziqli polimerlar boʻlib, L-aminokislota qoldiqlaridan iborat (ular monomerlar oqsillari tarkibida oʻzgartirilgan aminokislota qoldiqlari va aminokislota boʻlmagan tabiatning tarkibiy qismlari ham boʻlishi mumkin); Ilmiy adabiyotlarda aminokislotalarni belgilash uchun Lotin tilidagi bir yoki uch harfli qisqartmalar, masalan, valin uchun ishlatiladi: Val, V [23][24].Bir qarashda koʻpchilik oqsillarda „faqat“ 20 ta aminokislotadan foydalanish oqsil tuzilmalarining xilma-xilligini cheklab qoʻygandek tuyulishi mumkin boʻlsada, aslida ularning variantlari soni juda katta: 5 ta aminokislota qoldigʻi zanjiri 3 milliondan oshadi va 100 ta aminokislota qoldigʻi zanjiri (kichik protein) 10130dan ortiq variantda ifodalanishi mumkin. Uzunligi 2 dan bir necha oʻnlab aminokislota qoldiqlari boʻlgan zanjirlar koʻpincha polimerizatsiya darajasi yuqori boʻlgan „peptidlar“ deb ataladi, ammo bu boʻlinish juda oʻzboshimchalik bilan amalga oshiriladi. Bir aminokislotaning a-karboksil guruhining (-COOH) boshqa aminokislotaning amino guruhi (-NH2) bilan oʻzaro taʼsiri natijasida oqsil hosil boʻlganda, peptid bogʻ hosil boʻladi. Oqsilning uchlari terminal aminokislotalar qoldigʻi guruhlaridan qaysi biri erkin boʻlishiga qarab N- va C-terminus deb ataladi: mos ravishda -NH2 yoki -COOH. Ribosomadagi oqsil sintezida birinchi (N-terminal) aminokislota qoldigʻi odatda metionina boʻladi va keyingi qoldiqlar oldingisining C-terminusiga qoʻshiladi.
Tuzulish darajalari
[tahrir | manbasini tahrirlash]
K. Lindstrom oqsillarning strukturaviy tuzulishini 4 darajasini ajratishni taklif qildi: birlamchi, ikkilamchi, uchlamchi va toʻrtlamchi tuzilmalar. Bu boʻlinma biroz eskirgan boʻlsa ham, undan foydalanishda davom etmoqda[6]. Polipeptidning birlamchi tuzilishi (aminokislotalar qoldiqlari ketma-ketligi) uning gen va genetik kod tuzilishi bilan belgilanadi va yuqori tartibli tuzilmalar oqsillar jarayonida hosil boʻladi.
Birlamchi tuzilma
[tahrir | manbasini tahrirlash]
Birlamchi tuzulma — bu polipeptid zanjiridagi aminokislotalar qoldiqlarining ketma-ketligi. Proteinning asosiy tuzilishi aminokislotalar qoldiqlari uchun bir yoki uch harfli belgilar yordamida tasvirlanadi. Birlamchi tuzulmaning muhim xususiyatlari konservativ motivlar — maʼlum bir funktsiyani bajaradigan va koʻplab oqsillarda joylashgan aminokislotalar qoldiqlarining barqaror birikmalari. Konservativ motivlar turlarning evolyutsiyasi jarayonida saqlanib qoladi; ular koʻpincha nomaʼlum oqsil funktsiyasini bashorat qilish uchun ishlatilishi mumkin[25]. Turli organizmlar oqsillarining aminokislotalar ketma-ketligining hromologiyasi (oʻxshashligi) darajasidan kelib chiqib, bu organizmlar tegishli boʻlgan taksonlar orasidagi evolyutsion masofani taxmin qilish mumkin. Oqsilning birlamchi tuzilishini genetik kodlar jadvali yordamida oqsillarning RNKsini birlamchi tuzilishi bilan aniqlash mumkin.
Ikkilamchi tuzilma
[tahrir | manbasini tahrirlash]Ikkilamchi tuzulma vodorod bogʻlari bilan barqarorlashgan polipeptid zanjir boʻlagining mahalliy tartibidir. Quyida oqsil ikkilamchi tuzilishining eng keng tarqalgan turlari keltirilgan[26]
- a-spirallar — molekulaning uzun oʻqi atrofidagi zich burilishlar. Bir burilish 3,6 aminokislota qoldigʻi, spiral balandligi 0,54 nm (har bir qoldiq biokimyoviy aminokislotalar hisobi 0,15 nm).Spiral bir-biridan 4 birlik masofada joylashgan H va O peptid guruhlari orasidagi vodorod aloqalari bilan barqarorlashadi. a-spiral chap qoʻl yoki oʻng qoʻl boʻlishi mumkin boʻlsa-da, oqsillarda oʻng qoʻl ustunlik qiladi. Spiral elektrostatik oʻzaro taʼsirlar bilan buziladi glutamin kislota, lizina, arginina. Bir-biriga yaqin joylashgan asparagina, serina, treonina va leysina spiralning prolina qoldiqlarining shakllanishiga sterik tarzda xalaqit berishi zanjirning uzulishiga olib keladi, a-spirallar buzuladi;
- b-varaq (buklangan qatlamlar) — nisbatan uzoqdagilar oʻrtasida vodorod bogʻlari hosil boʻlgan bir nechta zigzag polipeptid zanjirlari (har bir aminokislota qoldigʻiga 0,34 nm[27]) birlamchi tuzilishdagi yoki turli oqsil zanjirlaridagi aminokislotalar va a-spiraldagi kabi bir-biriga yaqin boʻlmagan. Ushbu zanjirlar odatda qarama-qarshi yoʻnalishda (parallel yoʻnalish) yoki bir xil yoʻnalishda (parallel b-tuzilma) N-terminallariga ega. Bundan tashqari, parallel va antiparallel b-tuzilmalardan iborat aralash b-tuzilma mavjud boʻlishi mumkin[28]. B-varaqlarning hosil boʻlishi uchun yon guruhlar aminokislotalarining kichik oʻlchamlari muhim, odatda glisin va alanin ustunlik qiladi;
- p-spirallar;
- 310- spiral;
- tartibsiz boʻlaklar.
Uchlamchi tuzilma
[tahrir | manbasini tahrirlash]
Uchinchi darajali struktura polipeptid zanjirining fazoviy tuzilishidir. Strukturaviy jihatdan u har xil turdagi oʻzaro taʼsirlar bilan barqarorlashgan ikkilamchi struktura elementlaridan iborat boʻlib, ularda gidrofobik oʻzaro taʼsirlar hal qiluvchi rol oʻynaydi. Uchinchi darajali tuzilishni barqarorlashtirishda quyidagilar ishtirok etadi: kovalent bogʻlar (ikki qoldiq sisteina — disulfid koʻpriklari oʻrtasida);
- Aminokislota qoldiqlarining qarama-qarshi zaryadlangan ion guruhlari orasidagi ionli bogʻlar;
- vodorod bogʻlari;
- gidrofobik oʻzaro taʼsirlar. Atrofdagi suv molekulalari bilan oʻzaro taʼsirlashganda, oqsil molekulasi aminokislotalarning qutb boʻlmagan ion guruhlari suvli eritmadan ajratib olinadigan tarzda katlanadi; molekula yuzasida qutbli gidrofil ion guruhlar paydo boʻladi. Oqsillarning buklanish tamoyillarini oʻrganish shuni koʻrsatdiki, ikkilamchi tuzilish darajasi va atom fazoviy tuzilishi oʻrtasida boshqa darajani — buklama motivini (arxitektura, strukturaviy motiv) ajratish qulay. Buklanish motivi ikkilamchi tuzilish elementlarining (a-spirallar va b-torlar) oʻzaro joylashishi bilan belgilanadi. Oqsillar maydoni — oʻz-oʻzidan mavjud boʻlishi yoki kattaroq oqsil tarkibiga kirishi mumkin boʻlgan ixcham sharcha, boshqa oqsillar maydoni bilan birga. Bu motiv oqsillarning taxminan 10%ida uchraydiQatlamli motivlar maʼlum darajada saqlanib qolgan va funktsional, evolyutsion munosabatlarga ega boʻlmagan oqsillarda uchraydi. Motivlarini aniqlash oqsillarni fizik yoki ratsional tasnifiga asoslanadi (masalan, CATH yoki SCOP)[29].Oqsilning fazoviy tuzilishini aniqlash uchun rentgen nurlari difraksion tahlil usullari, yadro magnit-rezonansi va mikroskopning ayrim turlaridan foydalaniladi.
Toʻrtlamchi tuzilma
[tahrir | manbasini tahrirlash]Toʻrtlamchi tuzilishga ega boʻlgan oqsilni tashkil etuvchi oqsil molekulalari ribosomalarda alohida hosil boʻladi va faqat sintez tugagandan soʻng umumiy supramolekulyar tuzilmani hosil qiladi. Toʻrtlamchi tuzilishga ega boʻlgan oqsil bir xil va turli xil polipeptid zanjirlarini oʻz ichiga olishi mumkin. Bir xil turdagi oʻzaro taʼsirlar toʻrtlamchi tuzilmani barqarorlashtirishda uchinchi darajali tuzilishni barqarorlashtirishda ishtirok etadi. Supramolekulyar oqsil komplekslari oʻnlab molekulalardan iborat boʻlishi mumkin.
Tuzilish turi boʻyicha tasnifi
[tahrir | manbasini tahrirlash]Tuzilishning umumiy turiga koʻra oqsillarni uch guruhga boʻlish mumkin: Fibrillyar oqsillar— polimerlarni hosil qiladi, ularning tuzilishi odatda juda muntazam boʻlib, asosan turli zanjirlar orasidagi oʻzaro taʼsirlar orqali saqlanadi. Ular mikrofilamentlar, mikrotubulalar, fibrillalar hosil qiladi va hujayra toʻqimalarning tuzilishini qoʻllab-quvvatlaydi. Fibrillyar oqsillarga keratin va kollagen kiradi. Globulyar oqsillar suvda eriydi, molekulaning umumiy shakli ozmi-koʻpmi sharsimon. Membrana oqsillari — hujayra membranasi domenlarini kesib oʻtuvchi domenlarga ega, lekin ularning qismlari membranadan hujayralararo muhitga va hujayra sitoplazmasiga chiqib turadi. Membrana oqsillari retseptorlar vazifasini bajaradi, yaʼni signallarni uzatadi va turli moddalarning membrana orqali oʻtishini ham taʼminlaydi. Transporter oqsillari oʻziga xosdir, ularning har biri faqat maʼlum molekulalarni yoki maʼlum bir signal turini membranadan oʻtkazishga imkon beradi.
Oddiy va murakkab oqsillar
[tahrir | manbasini tahrirlash]Peptid zanjirlaridan tashqari, koʻpgina oqsillar aminokislotalar boʻlmagan guruhlarni ham oʻz ichiga oladi va bu mezonga koʻra, oqsillar ikkita katta guruhga boʻlinadi — oddiy va murakkab oqsillar (proteidlar). Oddiy oqsillar faqat polipeptid zanjirlaridan tashkil topgan murakkab oqsillar tarkibida aminokislota boʻlmagan yoki protez guruhlari ham mavjud. Protez guruhlarning kimyoviy tabiatiga qarab, murakkab oqsillar orasida quyidagi sinflar ajratiladi: Glikoproteinlar, protez guruhi sifatida kovalent bogʻlangan uglevodlar qoldiqlarini oʻz ichiga oladi; mukopolisaxaridlar qoldiqlarini oʻz ichiga olgan glikoproteinlar proteoglikanlar kichik sinfiga kiradi. Uglevod qoldiqlari bilan bogʻlanishning hosil boʻlishi odatda gidroksil guruhlari serina yoki treoninani oʻz ichiga oladi. Hujayradan tashqari oqsillarning aksariyati, xususan immunoglobulinlar glikoproteinlar deb tasniflanadi. Proteoglikanlarda uglevodlar qismi oqsil molekulasining umumiy massasining ~95% ni tashkil qiladi, ular hujayralararo matritsaning asosiy komponenti hisoblanadi; Lipoproteinlar tarkibida kovalent bogʻlanmagan lipidlar protez qismi sifatida, apolipoproteinlar oqsillari va ular bilan bogʻliq boʻlgan lipidlar tomonidan hosil boʻlgan lipoproteinlar qonda lipidlarni tashish uchun ishlatiladi; Metalloproteinlar, tarkibida gem boʻlmagan koordinatali bogʻlangan metall ionlari mavjud. Metalloproteinlar orasida saqlash va tashish funktsiyalarini bajaradigan oqsillar (masalan, temir saqlovchi ferritin va transferrin) va fermentlar (masalan, rux oʻz ichiga olgan karbonat angidirid va turli xil mis, marganets, temir va boshqa metallarning faol markazlarida ionlarni oʻz ichiga olgan superoksid dismutaz); Nukleoproteinlar tarkibida kovalent bogʻlanmagan DNK yoki RNK mavjud. Nukleoproteinlar tarkibiga xromatin kiradi, ularning tarkibiga xromosomalar ham kiradi; Fosfoproteinlar, protez guruhi sifatida kovalent bogʻlangan fosfor kislotasi qoldiqlarini oʻz ichiga oladi. Serin, treonin va tirozina ning gidroksil guruhlari fosfat bilan ester bogʻlanish hosil boʻlishida ishtirok etadi. Fosfoprotein, xususan, sutdagi kazein Xromoproteinlar, turli xil kimyoviy tabiatdagi rangli protez guruhlarini oʻz ichiga oladi. Bularga turli funktsiyalarni bajaradigan metall tarkibidagi porfirin protez guruhiga ega boʻlgan koʻplab oqsillar kiradi: emoproteinlar (protez guruhi sifatida gemni oʻz ichiga olgan oqsillar, masalan, gemoglobin va sitoxromlar ), xlorofillar, flavin guruhiga ega flavoproteinlar va boshqalar.
Manbalar
[tahrir | manbasini tahrirlash]- ↑ OʻzME. Birinchi jild. Toshkent, 2000-yil
- ↑ Kimyoviy nuqtai nazardan, barcha oqsillar polipeptidlar hisoblanadi. Ammo qisqa polipeptidlar, tarkibida 30 dan kam aminokislota qoldiqlari mavjud ayniqsa kimyoviy sintezlanganlarni oqsil deb atash mumkin emas.
- ↑ Nisbatan yaqinda yana 2 ta aminokislotalar — selenosistein va pirolizin topildi, ular arxeya hujayralarining oqsillari tarkibiga kiradi, ammo ularning tabiatda tarqalishi kichik. Shunday qilib, bugungi kunda 22 ta aminokislotalar allaqachon maʼlum boʻlib, ular tirik organizmlarning tabiiy genom tarkibiga kiritilgan irsiy maʼlumotlarga asoslangan biosintezlangan oqsillarning bir qismidir.
- ↑ Perutz M. F., Rossmann M. G., Cullis A. F., Muirhead H., Uill G., Shimoliy. A. C. Gemoglobinning tuzilishi: 5,5-A da uch o'lchovli Furye sintezi. rezolyutsiya, rentgen tahlili natijasida olingan. — 1960.
- ↑ Kendrew J. C., Bodo G., Dintzis H. M., Parrish R. G., Wyckoff H., Phillips D. C. Rentgen tahlili natijasida olingan miyoglobin molekulasining uch o'lchovli modeli. — 1958.
- ↑ 6,0 6,1
Proteinlar Muallif(lar) Yu . A. Ovchinnikov - ↑ Danilevskiy A.Ya. Oqsil moddalari haqida biologik va kimyoviy hisobotlar (kimyoviy konstitutsiya uchun materiallar va ularning biogenezi). — 1888. — B. 289.
- ↑
Proteinlar Muallif(lar) Tsvetkov L. A. Qismlar § 38. Oqsillar Nashriyot Prosveshcheniye - ↑ Andoza:Book
- ↑ 10,0 10,1
Proteinlar Muallif(lar) N. H. Barton, D. E. G. Briggs, J. A. Eisen Sahifalar soni /details/evolution0000unse_x9v3/page/38 38 ISBN 978-0-87969-684-9 - ↑ „F. Sangerning Nobel ma'ruzasi“. 2013-yil 5-yanvarda asl nusxadan arxivlangan. Qaraldi: 16-oktyabr.
- ↑ Sanger F., Tuppy H. Insulinning fenilalanil zanjiridagi aminokislotalar ketma-ketligi. 2. Fermentli gidrolizatlardan peptidlarni tekshirish. — 1951.
- ↑ {{maqola|muallif=Sanger F., Tompson E. O.|title=Insulinning glitsil zanjiridagi aminokislotalar ketma-ketligi. II. Fermentli gidrolizatlardan peptidlarni tekshirish|havola=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1198158/%7Cedition=Biochem J|yil=1953|jild=53|son=3|sahifalar=366—374|pmid=13032079} }
- ↑ Ovchinnikov Yu.A., Braunshtein A.E., Egorov T.A., Polyanovskiy O.L., Aldanova N.A., Feygina M.Yu., Lipkin V.M., Abdulaev N.G., Grishin E.V., Kiselev A.P., Modyanov N.N., Nosikov V.V. Fanlar {{{sarlavha}}}. — 1972.
- ↑ Filippovich Yu.B. {{{sarlavha}}}. — M., 1975.
- ↑ /home.do „Protein ma'lumotlar banki“. Rutgers va UCSD. — Biologik Makromolekulyar Resurs. 2012-yil 27-dekabrda asl nusxadan /www.rcsb.org/pdb/home/ home.do arxivlangan. Qaraldi: 2012-yil 26-dekabr.
- ↑ Yahav T., Maimon T., Grossman E., Dahan I., Medalia O. Krio-elektron tomografiya: tizimli yondashuvlar orqali hujayra jarayonlari haqida tushunchaga ega bo'lish. — 2011.
- ↑ Fulton A., Isaacs V. {{{sarlavha}}}. — 1991.
- ↑ 19,0 19,1 Andoza:Book
- ↑ „EC 3.4.23.1 — BRENDA axborot tizimidagi pepsin A Pepsin A“. 2008-yil 17-iyunda asl nusxadan arxivlangan. Qaraldi: 2008-yil 18-may.
- ↑ Singer. S. J. {{{sarlavha}}}. — 1990.
- ↑
3 jildda biokimyo Muallif(lar) Strayer L. Nashriyot Mir - ↑ {{{sarlavha}}}. — 1984-01-01.
- ↑ Andoza:Book
- ↑ Koonin E. V., Tatusov R. L., Galperin M. Y. To'liq genomlardan tashqari: ketma-ketlikdan tuzilish va funksiyaga. — 1998.
- ↑ Leniger
- ↑
Proteinlar Muallif(lar) Devid Uitford Sahifalar soni 542 ISBN 7 0471498940 - ↑ Finkelshtein A. V., Ptitsyn O. B. Polipeptid zanjirlarining ikkilamchi tuzilmalari // Proteinlar fizikasi. — Moskva: KDU, 2005. — S. 86-95. — ISBN 5-98227-065-2.
- ↑ Finkelstein
| Ushbu maqolada Oʻzbekiston milliy ensiklopediyasi (2000-2005) maʼlumotlaridan foydalanilgan. |
