Diazo birikmalar
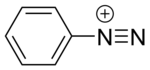
Diazo birikmalar yoki diazo tuzlari umumiy funksional guruhga ega boʻlgan organik birikmalar guruhidir. [R−N+≡N]X− - bu yerda R har qanday organik guruh boʻlishi mumkin, masalan, alkil yoki aril. X esa noorganik yoki organik anion, masalan, galogendir.
Umumiy xossalari va reaktivligi
[tahrir | manbasini tahrirlash]Arendiazo kationlari va tegishli turlari
[tahrir | manbasini tahrirlash]X-nurli kristallografiyaga koʻra: C−N+≡N - tipik diazo tuzlarida bogʻlanish chiziqli boʻladi. N+≡N benzodiazo tetrafloroboratdagi bogʻlanish masofasi 1,083 (3) Å ni tashkil qiladi,[1] dinitrogen molekulasi (N≡N) bilan deyarli bir xil.
Chiziqli erkin energiya konstantalari σm va σp diazo guruhining kuchli elektron tortib olishini koʻrsatadi. Shunday qilib, diazo bilan almashtirilgan fenollar va benzoik kislotalar oʻzlarining almashtirilmagan analoglari bilan solishtirganda pK a qiymatlarini sezilarli darajada kamaytiradilar. 4-gidroksibenzodiazoniyning fenol protonining pK a si fenolning oʻzi uchun 9,9 ga nisbatan 3,4[2] ga teng. Boshqacha qilib aytganda, diazo guruhi pK a ni (kislotalikni oshiradi) million barobarga kamaytiradi.
Arenediazon tuzlarining barqarorligi qarshi ionga juda sezgir. Fenildiazo xlorid xavfli portlovchi hisoblanadi, ammo benzodiazo tetrafloroborat skameykada oson ishlov beriladi.
SN1 va SN2 reaksiyalari yuzaga kelmaydi.
Arendiazo tuzlari keyingi boʻlimlarda tavsiflanganidek koʻp qirrali reagentlardir.[3] Elektrofil aromatik almashtirishdan soʻng, diazo kimyosi aromatik birikmalarni tayyorlash uchun eng koʻp ishlatiladigan strategiya hisoblanadi.
Alkanediazo kationlari va tegishli turlar
[tahrir | manbasini tahrirlash]Alkandiazo tuzlari SN2/SN1/E1 almashtirishga nisbatan oʻta reaktivligi tufayli sintetik jihatdan ahamiyatsiz. Biroq, bu kationlar nazariy jihatdan qiziqish uygʻotadi. Bundan tashqari, metildiazo karboksilat diazometan tomonidan karboksilik kislotalarning metillanishida oraliq vosita boʻlib, keng tarqalgan transformatsiya hisoblanadi.[4][5]
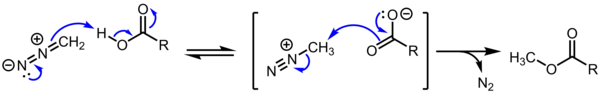
yoʻqotish N2 ham entalpik, ham entropik jihatdan qulay:
- [CH3N2]+ → [CH3]+ + N2, ΔH = −43 kcal/mol
- [CH3CH2N2]+ → [CH3CH2]+ + N2, ΔH = −11 kcal/mol
Ikkilamchi va uchlamchi darajali alkandiazo turlari uchun entalpik oʻzgarish minimal faollashuv toʻsigʻi bilan nolga yaqin yoki salbiy deb hisoblanadi. Ikkilamchi va uchlamchi darajali alkandiazo turlari yo bogʻlanmagan, mavjud boʻlmagan turlar, yoki eng yaxshi holatda ham juda tez oʻtuvchi oraliq mahsulotlardir.[6]
Metandiazoning suvli pKa ([CH3N2]+) <10 deb taxmin qilinadi.[7]
Tayyorgarlik
[tahrir | manbasini tahrirlash]Diazo birikmalarni hosil qilish jarayoni "diazotatsiya", "diazonlanish" yoki "diazotizatsiya" deb ataladi. Reaksiya haqida birinchi marta 1858-yilda Piter Griss xabar bergan, u keyinchalik bu yangi birikmalar sinfining bir nechta reaksiyalarini kashf etgan. Koʻpincha diazo tuzlari aromatik aminlarni nitrit kislotasi va qoʻshimcha kislota bilan reaksiya orqali tayyorlanadi. Odatda nitrit kislotasi natriy nitrit va ortiqcha mineral kislotadan (odatda suvli HCl,H2SO4, p-H3CC6H4SO3H, yoki H[BF4]):
- ArNH2 + HNO2 + HX → [ArN2]+X− + 2 H2O

Anʼanaviy ravishda anilin, natriy nitrit va xlorid kislotadan tayyorlangan diazo kationining xlorid tuzlari xona haroratida beqaror va klassik ravishda 0-5 °C haroratda tayyorlanadi. Shu bilan birga, diazo birikmalarini tetrafloroborat yoki tosilat tuzlari[8] sifatida ajratib olish mumkin, ular xona haroratida barqaror qattiq moddalardir.[9] Koʻpincha diazo tuzining eritmada qolishi maʼqul, lekin ular oʻta toʻyingan boʻladi.[10]
Ushbu xavflar tufayli diazo birikmalari koʻpincha izolyatsiya qilinmaydi. Buning oʻrniga ular in situ ishlatiladi. Bu yondashuv arensulfonil birikmasini tayyorlashda koʻrsatib oʻtilgan:[11]
Diazo-birikma reaksiyalari
[tahrir | manbasini tahrirlash]Diazo tuzlarining birinchi qoʻllanishi matoni diazoniy birikmasining suvli eritmasiga kiritish, soʻngra bogʻlovchi eritmasiga (elektrofil oʻrinbosar boʻlgan elektronga boy halqa) kiritish orqali suvga chidamli boʻyalgan matolarni ishlab chiqarish edi. Diazo birikmalarining asosiy qoʻllanishi boʻyoq va pigment sanoatiga toʻgʻri keladi.
Diazo tuzlarining eng koʻp qoʻllaniladigan reaksiyasi azo boʻyoqlar ishlab chiqarishda ishlatiladigan azo birlashma boʻlib qolmoqda.[12] Bu jarayonda diazo birikmasiga elektronga boy substratlar qoʻshiladi. Birlashtiruvchi sheriklar anilinlar va fenollar kabi arenlar boʻlsa, jarayon elektrofil aromatik almashtirishga namuna boʻladi:
- [ArN2]+ + Ar'H → ArN2Ar' + H+
Tijoriy jihatdan kerakli boʻlgan boshqa bogʻlovchi sheriklar sinfi asetoasetik amidlar boʻlib, ular diarilid pigmenti sariq pigment 12 ni tayyorlashda koʻrsatilgan.
Olingan azo birikmalar koʻpincha foydali boʻyoqlar boʻlib, aslida azo boʻyoqlar deb ataladi. Masalan, anilin sariq deb ataladigan boʻyoq anilin va diazo tuzining sovuq eritmasini aralashtirib, keyin uni kuchli silkitish orqali hosil boʻladi.[13] Xuddi shunday, Naftalin-2-ol (beta-naftol) ning sovuq asosli eritmasi kuchli toʻq sariq-qizil choʻkma beradi.[13] Metil apelsin laboratoriyada pH koʻrsatkichi sifatida ishlatiladigan azo boʻyoqning namunasi hisoblanadi.
N2 guruhning siljishi
[tahrir | manbasini tahrirlash]Arenediazo kationlari bir qancha reaksiyalarga kirishadi. N2 guruhi boshqa guruh yoki ion bilan almashtiriladi. Asosiylaridan baʼzilari quyidagilardir:[14][15]
Biaril birikmasi
[tahrir | manbasini tahrirlash]Bir juft diazo kationlari biaril hosil qilish uchun birlashtirilishi mumkin. Ushbu konversiya antranilik kislotadan olingan diazo tuzining difenik kislota hosil qilish uchun ulanishi bilan tasvirlangan ((C6H4CO2H)2).[16] Tegishli reaksiyada bir xil diazo tuzi yoʻqoladi. N2 va CO2 benzol hosil qiladi.[17]
Galogenidlar bilan almashtirish
[tahrir | manbasini tahrirlash]Sandmeyer reaksiyasi
[tahrir | manbasini tahrirlash]Benzodiazo xlorid HCl yoki HBr da erigan mis xlorid yoki mis bromid bilan qizdirilsa, mos ravishda xlorbenzol yoki brombenzol hosil boʻladi.
- [C6H5N2]+ + CuCl → C6H5Cl + N2 + Cu+
Gatterman reaksiyasi
[tahrir | manbasini tahrirlash]Gatterman reaksiyasida benzodiazo xlorid mis kukuni va HCl yoki HBr bilan birgalikda qizdiriladi va mos ravishda xlorbenzol va bromobenzol hosil boʻladi. Unga nemis kimyogari Lyudvig Gatterman sharafiga nom berilgan.[18]
- 2 Cu + 2 [C6H5N2]+ → 2 Cu+ + (C6H5)2 + 2 N2 (initiation)
- [C6H5N2]+ + HX → C6H5X + N2 + H+ (Cu+ catalysis)
Yodid bilan almashtirish
[tahrir | manbasini tahrirlash]Arendiazo kationlari kaliy yodid bilan reaksiyaga kirishib aril yodid hosil qilishi maʼlum:[19]
- [C6H5N2]+ + KI → C6H5I + K+ + N2
Ftorid bilan almashtirish
[tahrir | manbasini tahrirlash]Ftorbenzol benzodiazoni tetraftorboratning termal parchalanishi natijasida hosil boʻladi. Ushbu Konversiya Balz-Shieman reaksiyasi deb ataladi.[20]
- [C6H5N2]+[BF4]− → C6H5F + BF3 + N2
Anʼanaviy Balz-Schiemann reaksiyasi koʻplab motivatsiyalarga sabab boʻldi, masalan, geksaftorfosfat (V) dan foydalanish ([PF6]−) va geksafluoroantimonat (V) ([SbF6]−) tetraftoroborat oʻrniga ([BF4]−). Diazotizatsiya nitrozoniy geksaftoroantimonat (V) kabi nitroziy tuzlari bilan amalga oshirilishi mumkin.[NO]+[SbF6]− .[21]
Turli xil almashtirishlar
[tahrir | manbasini tahrirlash]Vodorod bilan almashtirish
[tahrir | manbasini tahrirlash]Gipofosfat kislotasi,[22] etanol,[23] natriy stanit[24] yoki ishqoriy natriy tiosulfat[25] qaytarilgan arenediazo kationlari benzolni beradi:
- [C6H5N2]+Cl− + H3PO2 + H2O → C6H6 + N2 + H3PO3 + HCl
- [C6H5N2]+Cl− + CH3CH2OH → C6H6 + N2 + CH3CHO + HCl
- [C6H5N2]+Cl− + NaOH + Na2SnO2 → C6H6 + N2 + Na2SnO3 + NaCl
Baeyer va Pfitzinger tomonidan taklif qilingan muqobil usul - diazoguruhni H bilan almashtirish: birinchi navbatda uni gidrazin bilan tasirlashtirish orqali hosil qilish. Keyinchalik mis sulfat eritmasi bilan qaynatish orqali uglevodorodga oksidlanadi.[26]
Gidroksil guruhi bilan almashtirish
[tahrir | manbasini tahrirlash]Fenollar arendiazo tuzlarining suvdagi eritmalarini qizdirish orqali hosil boʻladi (bunda gidroliz jarayoni sodir boʻladi):[27][28][29][30]
- [C6H5N2]+ + H2O → C6H5OH + N2 + H+
Bu reaksiya nemischa Phenolverkochung ("fenollar hosil qilish uchun pishirish") deb ataladi. Hosil boʻlgan fenol diazo tuzi bilan reaksiyaga kirishishi mumkin va shuning uchun reaksiya bu keyingi reaksiyani yordam beradigan kislota ishtirokida amalga oshiriladi.[31] Sandmeyer tipidagi gidroksillanishdan foydalanish ham mumkin Cu2O va Cu2+. Ushbu jarayon suvda olib boriladi.
Nitro guruhi bilan almashtirish
[tahrir | manbasini tahrirlash]Nitrobenzolni benzodiazoniy ftorboratni natriy nitrit bilan mis ishtirokida taʼsir ettirish orqali olish mumkin. Shu bilan bir qatorda, anilinning diazotizatsiyasi, oʻz-oʻzidan mis nitritini hosil qiluvchi mis oksidi ishtirokida amalga oshirilishi mumkin:
- [C6H5N2]+ + CuNO2 → C6H5NO2 + N2 + Cu+
Siano guruhi bilan almashtirish
[tahrir | manbasini tahrirlash]Siano guruhini odatda galoarenlarning nukleofil oʻrnini bosishi bilan kiritib boʻlmaydi, ammo bunday birikmalarni diazo tuzlaridan osongina tayyorlash mumkin. Koʻruvchi sianid reagentidan foydalangan holda benzonitrilni tayyorlash misoli:
- [C6H5N2]+ + CuCN → C6H5CN + Cu+ + N2
Bu reaksiya Sandmeyer reaksiyasining maxsus turidir.
Triflorometil guruhi bilan almashtirish
[tahrir | manbasini tahrirlash]Ikki tadqiqot guruhi 2013-yilda diazo tuzlarining triftorometilatsiyasi haqida xabar berdi. Goossen tayyorlash haqida maʼlum qildi. CuCF3,CuSCN dan kompleksi,TMSCF3 va Cs2CO3 . Bundan farqli oʻlaroq, Fu Umemoto reaktivi (S -triftorometildibenzotiofenium tetraftoroborat) va Cu kukuni (Gattermann tipidagi shartlar) yordamida triftorometilatsiya haqida xabar berdi. Ularni quyidagi tenglama bilan tavsiflash mumkin:
- [C6H5N2]+ + [CuCF3] → C6H5CF3 + [Cu]+ + N2
Qavs misdagi boshqa ligandlar mavjudligini koʻrsatadi, ammo ular kiritilmagan.
Aril guruhi bilan almashtirish
[tahrir | manbasini tahrirlash]Diazo tuzlari ikki bosqichli bajarish tartibida tiollarga aylantirilishi mumkin. Benzendiazo xloridni kaliy etilksantat bilan davolash, soʻngra oraliq ksantat efirini gidrolizlash tiofenolni beradi:
- [C6H5N2]+ + C2H5OCS−2 → C6H5SC(S)OC2H5 + N2
- C6H5SC(S)OC2H5 + H2O → C6H5SH + HOC(S)OC2H5
Boronat efir guruhi bilan almashtirish
[tahrir | manbasini tahrirlash]Aril guruhini arendiazo tuzlari yordamida boshqasiga ulash mumkin. Masalan, benzodiazoniy xloridni benzol (aromatik birikma) bilan natriy gidroksid ishtirokida reaksiyaga kirishi difenilni beradi:
- [C6H5N2]+Cl− + C6H6 → (C6H5)2 + N2 + HCl
Bu reaksiya Gomberg-Bachmann reaksiyasi deb nomlanadi. Xuddi shunday konversiyaga benzodiazo xloridni etanol va mis kukuni bilan taʼsirlashtirish orqali ham erishiladi.
Formil guruhi bilan almashtirish
[tahrir | manbasini tahrirlash]Suzuki-Miyaura oʻzaro bogʻlanish reaksiyalarida qoʻllaniladigan Bpin (pinakolatoboron) guruhini diazo tuzining bi (pinakolato) dibor bilan benzoil peroksid (2) ishtirokida reaksiyasi orqali oʻrnatish mumkin. .[32] Shu bilan bir qatorda shunga oʻxshash borillanishga oʻtish metalli karbonil komplekslari, shu jumladan dimanganez dekakarbonil yordamida amalga mumkin.[33]
- [C6H5N2]+X− + pinB−Bpin → C6H5Bpin + X−Bpin + N2
Aril diazo tuzini formaldoksim bilan taʼsirlashtirish orqali formil guruhi -CHO ni kiritish mumkin H2C=NOH , soʻngra aril aldoksim gidrolizlanib, aril aldegid hosil boʻladi.[34] Bu reaksiya Beech reaksiyasi deb nomlanadi.[35]
Boshqa dediazotizatsiyalar
[tahrir | manbasini tahrirlash]- elektrodda organik qaytarilish orqali
- askorbin kislotasi (vitamin C) kabi yengil qaytaruvchi vositalar[36]
- suvda hosil boʻlgan solvatlangan elektronlardan gamma nurlanishi bilan
- fotoinduktsiyali elektron uzatish
- metall kationlari, koʻpincha mis tuzi bilan qaytarilishi.
- anion induksiyasi: yod kabi qarshi ion aril radikalini va yod radikalini hosil qiluvchi diazoniy kationiga elektron oʻtkazishni taʼminlaydi.
Meerwein reaksiyasi
[tahrir | manbasini tahrirlash]Benzo diazo xlorid faollashtirilgan qoʻsh bogʻlarni (faollashtiriligan ikki tomonlama aloqa) oʻz ichiga olgan birikmalar bilan reaksiyaga kirishib, fenillangan mahsulotlar hosil qiladi. Reaksiya Meerwein arilatsiyasi deb ataladi:
- [C6H5N2]+Cl− + ArCH=CH−COOH → ArCH=CH−C6H5 + N2 + CO2 + HCl
Metall komplekslar
[tahrir | manbasini tahrirlash]Metall komplekslari bilan reaksiyalarida diazo kationlari xuddi shunday harakat qiladi - NO+ . Masalan, quyi valentli metall komplekslari diazo tuzlari bilan birikadi. Tasviriy komplekslar [Fe(CO)2(PPh3)2(N2Ph)]+ va metall-xiral kompleksi Fe(CO)(NO)(PPh3)(N2Ph) .[37]
Payvandlash reaksiyalari
[tahrir | manbasini tahrirlash]Nanotexnologiyada potensial qoʻllanishida diazo tuzlari 4-xlorbenzodiazo tetraftoroborat bir devorli nanotrubalarni juda samarali ishlaydi.[38] Nanotrubalarni tozalash uchun ular ionli suyuqlik bilan ohak va maydalagichda aralashtiriladi. Diazo tuzi kaliy karbonat bilan birga qoʻshiladi va aralashmani xona haroratida maydalagandan soʻng nanotrubkalar yuzasi 44 uglerod atomiga 1 samaradorlikda xlorofenil guruhlari bilan qoplanadi. Ushbu qoʻshilgan oʻrinbosarlar, ular orasidagi katta birlashtiruvchi kuchlar tufayli quvurlarning yaqin toʻplamlar hosil boʻlishiga yoʻl qoʻymaydi, bu nanotruba texnologiyasida takrorlanadigan muammodir.
Bundan tashqari, aril monoqatlamini tashkil etuvchi diazo tuzlari bilan kremniy qoplamalarini funksionallashtirish mumkin. Bir tadqiqotda kremniy yuzasi ammoniy vodorod ftorid bilan yuvilib, u kremniy-vodorod bogʻlari bilan qoplanadi (gidrid passivatsiyasi).[39] Sirtning diazo tuzining asetonitrildagi eritmasi bilan 2 soat davomida qorongʻudagi reaksiyasi, erkin radikal mexanizm orqali oʻz-oʻzidan sodir boʻladigan jarayon hisoblanadi:[40]

Hozirgacha diazo tuzlarini metallarga payvand qilish quyidagi elementlar yuzalarida amalga oshirilgan: temir, kobalt, nikel, platina, palladiy, rux, mis va oltin.[41] Shuningdek, olmos yuzalariga payvand qilingani haqida maʼlumot mavjud.[42] Qiziqarli savollardan biri sirtdagi aril guruhidagi haqiqiy joylashuvdir. Silikonda oʻtkazilgan tadqiqot[43] shuni koʻrsatadiki: titandan misga qadar boʻlgan davrda 4 elementning bogʻlanish energiyasi chapdan oʻngga kamayadi, chunki d-elektronlarning soni ortib boradi. Temirning chap tomonidagi metallar yuza tomon egilgan yoki tekis joylashgan boʻlib, metall bilan uglerod pi bogʻlari hosil boʻlishiga yordam beradi va temirning oʻng tomonidagilar tik holatda joylashgan boʻlib, metalldan uglerod sigma bogʻlanishiga yordam beradi.
Gidrazin guruhiga qisqarish
[tahrir | manbasini tahrirlash]Diazo tuzlarini kaliy xlorid bilan (SnCl2) mos keladigan gidrazin hosilalariga kamaytirish mumkin. Bu reaksiya, ayniqsa, triptan birikmalari va indometatsinning Fisher indol sintezida foydalidir. Natriy ditionitdan foydalanish kaliy xloridga nisbatan yaxshiroqdir, chunki u kamroq ekologik muammolarga ega boʻlgan, arzonroq qaytaruvchi moddadir.
Biokimyo
[tahrir | manbasini tahrirlash]Organik kimyoda oz uchraydigan alkandiazo ionlari kanserogenlarning qoʻzgʻatuvchisi sifatida ishtirok etadi. Xususan, nitrozaminlar alkandiazo turlarini ishlab chiqarish uchun metabolik faollashuvga uchrashi maʼlum.

Xavfsizlik
[tahrir | manbasini tahrirlash]Qattiq diazo galogenidlari koʻpincha xavfli portlovchi hisoblanadi, ular bilan ishlashda oʻlim va jarohatlar haqida xabar berilgan.[10]
Anionlarning tabiati tuzning barqarorligiga taʼsir qiladi. Nitrobenzo diazo perxlorat kabi arendiazo perxloratlar portlovchi moddalarni ishga tushirish uchun ishlatilgan.
Islom Otaqulov
Yana qarang
[tahrir | manbasini tahrirlash]- Diazo
- Diazo bosib chiqarish jarayoni
- Benzendiazoniy xlorid
- Triazenning parchalanishi
- Dinitrogen kompleksi
Manbalar
[tahrir | manbasini tahrirlash]- ↑ Cygler, Miroslaw; Przybylska, Maria; Elofson, Richard Macleod (1982). „The Crystal Structure of Benzenediazonium Tetrafluoroborate, C6H5N2+•BF4−1“. Canadian Journal of Chemistry. 60-jild, № 22. 2852–2855-bet. doi:10.1139/v82-407.
- ↑ D. Bravo-Díaz, Carlos (15-oktabr 2010-yil), „Diazohydroxides, Diazoethers and Related Species“, in Rappoport, Zvi (muh.), PATai's Chemistry of Functional Groups (inglizcha), John Wiley & Sons, Ltd, doi:10.1002/9780470682531.pat0511, ISBN 9780470682531
{{citation}}: CS1 maint: date format () - ↑ Norman, R. O. C. (Richard Oswald Chandler). Principles of Organic Synthesis, 3rd, CRC Press, 2017. ISBN 9780203742068. OCLC 1032029494.
- ↑ Streitwieser, Andrew; Schaeffer, William D. (1957-yil iyun). „Stereochemistry of the Primary Carbon. VI. The Reaction of Optically Active 1-Aminobutane-1-d with Nitrous Acid. Mechanism of the Amine-Nitrous Acid Reaction1“. Journal of the American Chemical Society. 79-jild, № 11. 2888–2893-bet. doi:10.1021/ja01568a054.
{{cite magazine}}: sana kiritilishi kerak boʻlgan parametrga berilgan qiymatni tekshirish lozim:|date=(yordam) - ↑ Friedman, Lester; Jurewicz, Anthony T.; Bayless, John H. (1969-yil mart). „Influence of solvent on diazoalkane-alkanediazonium ion equilibriums in amine deaminations“. Journal of the American Chemical Society. 91-jild, № 7. 1795–1799-bet. doi:10.1021/ja01035a032.
{{cite magazine}}: sana kiritilishi kerak boʻlgan parametrga berilgan qiymatni tekshirish lozim:|date=(yordam) - ↑ Carey, Francis A.. Advanced organic chemistry, Sundberg, Richard J., 5th, New York: Springer, 2007. ISBN 9780387448978. OCLC 154040953.
- ↑ Fei, Na; Sauter, Basilius; Gillingham, Dennis (2016). „The pK a of Brønsted acids controls their reactivity with diazo compounds“. Chemical Communications (inglizcha). 52-jild, № 47. 7501–7504-bet. doi:10.1039/C6CC03561B. PMID 27212133.
- ↑ Filimonov, Victor D.; Trusova, Marina; Postnikov, Pavel; Krasnokutskaya, Elena A.; Lee, Young Min; Hwang, Ho Yun; Kim, Hyunuk; Chi, Ki-Whan (18-sentabr 2008-yil). „Unusually Stable, Versatile, and Pure Arenediazonium Tosylates: Their Preparation, Structures, and Synthetic Applicability“. Organic Letters (inglizcha). 10-jild, № 18. 3961–3964-bet. doi:10.1021/ol8013528. ISSN 1523-7060. PMID 18722457.
{{cite magazine}}: CS1 maint: date format () - ↑ Mihelač, M.; Siljanovska, A.; Košmrlj, J. (2021). „A convenient approach to arenediazonium tosylates“. Dyes Pigm. 184-jild. 108726-bet. doi:10.1016/j.dyepig.2020.108726.
- ↑ 10,0 10,1 „UK CRHF Incident Report – Supersaturated Diazonium salt causes Fatality“. UK Chemical Reaction Hazards Forum. 2018-yil 6-oktyabrda asl nusxadan arxivlangan. Qaraldi: 13-may 2010-yil.
- ↑ R. V. Hoffman (1981). „m-Trifluoromethylbenzenesulfonyl Chloride“. Org. Synth. 60-jild. 121-bet. doi:10.15227/orgsyn.060.0121.
- ↑ Chemistry of the Diazonium and Diazo Groups: Part 1. S. Patai, Ed. 1978 Wiley-Blackwell. ISBN 0-471-99492-8. Chemistry of the Diazonium and Diazo Groups: Part 2. S. Patai, Ed. 1978 Wiley-Blackwell. ISBN 0-471-99493-6.
- ↑ 13,0 13,1 Clark. „chemguide“. Qaraldi: 28-sentabr 2011-yil.
- ↑ March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 978-0-471-60180-7.
- ↑ Marye Anne Fox. Organic Chemistry, 3, illustrated, Jones & Bartlett Learning, 2004 — 535–538-bet. ISBN 978-0-7637-2197-8.
- ↑ Atkinson, E. R.; Lawler, H. J. (1927). „Diphenic Acid“. Org. Synth. 7-jild. 30-bet. doi:10.15227/orgsyn.007.0030.
- ↑ Logullo, F. M.; Seitz, A. H.; Friedman, L. (1968). „Benzenediazonium-2-carboxy- and Biphenylene“. Org. Synth. 48-jild. 12-bet. doi:10.15227/orgsyn.048.0012.
- ↑ L. Gattermann (1894). „Untersuchungen über Diazoverbindungen“. Berichte der Deutschen Chemischen Gesellschaft. 23-jild, № 1. 1218–1228-bet. doi:10.1002/cber.189002301199.
- ↑ Lucas, H. J.; Kennedy, E. R. (1939). „Iodobenzene“. Org. Synth. 19-jild. 55-bet. doi:10.15227/orgsyn.019.0055.
- ↑ Flood, D. T. (1933). „Fluorobenzene“. Org. Synth. 13-jild. 46-bet. doi:10.15227/orgsyn.013.0046..
- ↑ Furuya, Takeru; Klein, Johannes E. M. N.; Ritter, Tobias (2010). „C–F Bond Formation for the Synthesis of Aryl Fluorides“. Synthesis. 2010-jild, № 11. 1804–1821-bet. doi:10.1055/s-0029-1218742. PMC 2953275. PMID 20953341.
- ↑ Reinhard Bruckner, ed. Michael Harmata; Organic Mechanisms Reactions, Stereochemistry and Synthesis 3rd Ed, p.246, ISBN 978-3-8274-1579-0
- ↑ DeTarr, D.F.; Kosuge, T. (1958). „Mechanisms of Diazonium Salt Reactions. VI. The Reactions of Diazonium Salts with Alcohols under Acidic Conditions; Evidence for Hydride Transfer1“. Journal of the American Chemical Society. 80-jild, № 22. 6072–6077-bet. doi:10.1021/ja01555a044.
- ↑ Friedlander, Ber., 1889, 587, 22
- ↑ Grandmougin, Ber., 1907, 40, 858
- ↑ Baeyer & Pfitzinger, Ber., 1885, 18, 90, 786
- ↑ H. E. Ungnade, E. F. Orwoll (1943). „3-Bromo-4-hydroxytoluene“. Org. Synth. 23-jild. 11-bet. doi:10.15227/orgsyn.023.0011.
- ↑ Kazem-Rostami, Masoud (2017). „Facile Preparation of Phenol“. Synlett. 28-jild, № 13. 1641–1645-bet. doi:10.1055/s-0036-1588180.
- ↑ Carey, F. A.. Advanced Organic Chemistry. Vol. B, Chapter 11: Springer, 2007 — 1028-bet.
- ↑ Khazaei, Ardeshir; Kazem-Rostami, Masoud; Zare, Abdolkarim; Moosavi-Zare, Ahmad Reza; Sadeghpour, Mahdieh; Afkhami, Abbas (2013). „Synthesis, characterization, and application of a triazene-based polysulfone as a dye adsorbent“. Journal of Applied Polymer Science. 129-jild, № 6. 3439–3446-bet. doi:10.1002/app.39069.
- ↑ R. H. F. Manske (1928). „m-Nitrophenol“. Org. Synth. 8-jild. 80-bet. doi:10.15227/orgsyn.008.0080.
- ↑ Wu, Jie; Gao, Yueqiu; Qiu, Guanyinsheng; He, Linman (20-avgust 2014-yil). „Removal of amino groups from anilines through diazonium salt-based reactions“. Organic & Biomolecular Chemistry (inglizcha). 12-jild, № 36. 6965–6971-bet. doi:10.1039/C4OB01286K. ISSN 1477-0539. PMID 25093920.
{{cite magazine}}: CS1 maint: date format () - ↑ Fairlamb, Ian; Firth, James D.; Hammarback, L. Anders; Burden, Thomas J.; Eastwood, Jonathan B.; Donald, James R.; Horbaczewskyj, Chris S.; McRobie, Matthew T.; Tramaseur, Adam (2020). „Light‐ and Manganese‐Initiated Borylation of Aryl Diazonium Salts: Mechanistic Insight on the Ultrafast Time‐Scale Revealed by Time‐Resolved Spectroscopic Analysis“. Chemistry – A European Journal. 27-jild, № 12. 3979–3985-bet. doi:10.1002/chem.202004568. PMID 33135818.
- ↑ „Organic Syntheses Procedure“ (inglizcha). 2-bromo-4-methylbenzaldehyde. 2013-yil 20-dekabrda asl nusxadan arxivlangan. Qaraldi: 4-may 2021-yil.
- ↑ Beech, W. F. (1-yanvar 1954-yil). „Preparation of aromatic aldehydes and ketones from diazonium salts“. Journal of the Chemical Society (Resumed) (inglizcha). 1297–1302-bet. doi:10.1039/JR9540001297. ISSN 0368-1769.
{{cite magazine}}: CS1 maint: date format () - ↑ Pinacho Crisóstomo Fernando (2014). „Ascorbic Acid as an Initiator for the Direct C-H Arylation of (Hetero)arenes with Anilines Nitrosated In Situ“. Angewandte Chemie International Edition. 53-jild, № 8. 2181–2185-bet. doi:10.1002/anie.201309761. PMID 24453180.
- ↑ Sutton, D (1993). „Organometallic Diazo Compounds“. Chem. Rev. 93-jild, № 3. 905–1022-bet. doi:10.1021/cr00019a008.
- ↑ Price, B. Katherine (2005). „Green Chemical Functionalization of Single-Walled Carbon Nanotubes in Ionic Liquids“. Journal of the American Chemical Society. 127-jild, № 42. 14867–14870-bet. doi:10.1021/ja053998c. PMID 16231941.
- ↑ Michael P. Stewart; Francisco Maya; Dmitry V. Kosynkin; et al. (2004). „Direct Covalent Grafting of Conjugated Molecules onto Si, GaAs, and Pd Surfaces from Arenediazonium Salts“. J. Am. Chem. Soc. 126-jild, № 1. 370–8-bet. doi:10.1021/ja0383120. PMID 14709104.
- ↑ Reaction sequence: silicon surface reaction with ammonium hydrogen fluoride creates hydride layer. An electron is transferred from the silicon surface to the diazonium salt in an open circuit potential reduction leaving a silicon radical cation and a diazonium radical. In the next step a proton and a nitrogen molecule are expelled and the two radical residues recombine creating a surface silicon to carbon bond.
- ↑ Bélanger, Daniel; Pinson, Jean (2011). „Electrografting: a powerful method for surface modification“. Chemical Society Reviews (inglizcha). 40-jild, № 7. 3995–4048-bet. doi:10.1039/c0cs00149j. ISSN 0306-0012. PMID 21503288.
- ↑ S.Q. Lud; M. Steenackers; P. Bruno; et al. (2006). „Chemical Grafting of Biphenyl Self-Assembled Monolayers on Ultrananocrystalline Diamond“. J. Am. Chem. Soc. 128-jild, № 51. 16884–91-bet. doi:10.1021/ja0657049. PMID 17177439.
- ↑ De-en Jiang; Bobby G. Sumpter; Sheng Dai (2006). „Structure and Bonding between an Aryl Group and Metal Surfaces“. J. Am. Chem. Soc. 128-jild, № 18. 6030–1-bet. doi:10.1021/ja061439f. PMID 16669660.
- ↑ Tricker, A.R.; Preussmann, R. (1991). "Carcinogenic N-Nitrosamines in the Diet: Occurrence, Formation, Mechanisms and Carcinogenic Potential". Mutation Research/Genetic Toxicology 259 (3–4): 277–289. doi:10.1016/0165-1218(91)90123-4. PMID 2017213.
Havolalar
[tahrir | manbasini tahrirlash]- W. Reusch. „Reactions of Amines“. VirtualText of Organic Chemistry. Michigan State University. 2012-yil 12-dekabrda asl nusxadan arxivlangan.




