Aluminiy gidrid
Alyuminiy gidrid (shuningdek, alan yoki alumen deb ham ataladi) AlH3 formulasiga ega noorganik birikmadir. U oq qattiq modda sifatida namoyon bo'ladi va zarrachalar hajmi va nopoklik darajasining pasayishi bilan kulrang rangga ega bo'lishi mumkin. Sintez sharoitlariga qarab, alanning yuzasi yupqa alyuminiy oksidi va/yoki gidroksid qatlami bilan passivlashtirilishi mumkin. Alan va uning hosilalari organik sintezda reduktor sifatida ishlatiladi.
Alan polimerdir. Demak, uning formulasi ba'zan (AlH 3) n formulasi bilan ifodalanadi. Alan ko'p polimorflarni hosil qiladi, ular -alane, '-alane, -alane, -alane, -alane, -alane va -alane deb nomlanadi. -alan kub yoki rombedral morfologiyaga ega, '-alan esa ignasimon kristallar hosil qiladi va g-alan birlashtirilgan ignalar to'plamini hosil qiladi. Alan tetrahidrofuran (THF) va efirda eriydi. Efirdan qattiq alanning cho'kish tezligi tayyorlash usuliga qarab o'zgaradi.
-alanning kristall tuzilishi aniqlangan va 6 ta vodorod atomi bilan o'ralgan alyuminiy atomlaridan iborat bo'lib, ular 6 ta boshqa alyuminiy atomlari bilan bog'lanadi. Al-H masofalari hammasi ekvivalent (172pm) va Al-H-Al burchagi 141°.[1]
| </img> | </img> | </img> |
| -AlH 3 birlik hujayra | Al muvofiqlashtirish | H muvofiqlashtirish |
-Alan termal jihatdan eng barqaror polimorf hisoblanadi. -alan va -alan birgalikda hosil bo'ladi va qizdirilganda a-alanga aylanadi. , va -alan boshqa kristallanish sharoitida ham hosil bo'ladi. Ular kamroq termal barqaror bo'lsa-da, , va polimorflari qizdirilganda a-alanga aylanmaydi.
Alanning molekulyar shakllari
[tahrir | manbasini tahrirlash]Monomerik AlH 3 past haroratda qattiq asil gaz matritsasida ajratilgan va tekisligi ko'rsatilgan.[2] Al 2 H 6 dimeri qattiq vodorodda ajratilgan. U diboran (B 2 H 6) va digallan (Ga 2 H 6) bilan izostruktivdir.[3][4]
Olinishi
[tahrir | manbasini tahrirlash]Alyuminiy gidridlari va ularning turli komplekslari uzoq vaqtdan beri ma'lum.[5] Uning birinchi sintezi 1947-yilda nashr etilgan va sintez uchun patent 1999-yilda berilgan[6] Alyuminiy gidrid lityum alyuminiy gidridni alyuminiy triklorid bilan davolash orqali tayyorlanadi.[7] Jarayon juda murakkab: litiy xloridni olib tashlashga e'tibor berish kerak.
- 3 LiAlH 4 + AlCl 3 → 4 AlH 3 + 3 LiCl
Alanning efir eritmasi darhol foydalanishni talab qiladi, chunki polimer material qattiq holda tez cho'kadi. Alyuminiy gidrid eritmalari 3 kundan keyin parchalanishi ma'lum. Alyuminiy gidrid LiAlH 4 dan ko'ra ko'proq reaktivdir.
Alyuminiy gidridni tayyorlashning yana bir qancha usullari mavjud:
- 2 LiAlH 4 + BeCl 2 → 2 AlH 3 + Li 2 BeH 2 Cl 2
- 2 LiAlH 4 + H 2 SO 4 → 2 AlH 3 + Li 2 SO 4 + 2 H 2
- 2 LiAlH 4 + ZnCl 2 → 2 AlH 3 + 2 LiCl + ZnH 2
- 2 LiAlH 4 + I 2 → 2 AlH 3 + 2 LiI + H 2
Elektrokimyoviy sintez
[tahrir | manbasini tahrirlash]Bir qancha guruhlar alanning elektrokimyoviy yo'l bilan ishlab chiqarilishi mumkinligini ko'rsatdi.[8][9][10][11][12] Turli elektrokimyoviy alan ishlab chiqarish usullari patentlangan. Elektrokimyoviy hosil qiluvchi alan xlorid aralashmalaridan qochadi. Erituvchi sifatida THF, elektrolit sifatida natriy alyuminiy gidrid, alyuminiy anod va katod sifatida simob (Hg) ga botgan temir (Fe) simni o'z ichiga olgan Klasen elektrokimyoviy xujayrasida alan hosil bo'lishining ikkita mumkin bo'lgan mexanizmi muhokama qilinadi. Natriy Hg katodi bilan amalgam hosil qiladi, bu esa yon reaksiyalarni oldini oladi va birinchi reaksiyada hosil bo'lgan vodorod ushlanib, natriy gidridni ishlab chiqarish uchun natriy simob amalgam bilan reaksiyaga kirishishi mumkin. Clasen tizimi boshlang'ich materialni yo'qotmaydi. Erimaydigan anodlar uchun 1-reaksiya sodir bo'ladi, eriydigan anodlar uchun esa 2-reaksiyaga muvofiq anodik erish kutiladi:
- AlH 4 - - e - → AlH 3 · nTHF + H 2
- 3AlH 4 - + Al - 3e - → 4AlH 3 · nTHF
2-reaksiyada alyuminiy anod iste'mol qilinadi, ma'lum bir elektrokimyoviy hujayra uchun alyuminiy gidrid ishlab chiqarishni cheklaydi.
Elektrokimyoviy hosil bo'lgan alandan alyuminiy gidridning kristallanishi va tiklanishi ko'rsatildi.[11][12]
Alyuminiy metallni yuqori bosimli gidrogenlash
[tahrir | manbasini tahrirlash]-AlH 3 alyuminiy metallni 10GPa va 600 °C (1,112 °F) da gidrogenlash orqali ishlab chiqarilishi mumkin.. Suyultirilgan vodorod o'rtasidagi reaksiya atrof-muhit sharoitida tiklanishi mumkin bo'lgan -AlH 3 ni hosil qiladi.[13]
Reaksiyalar
[tahrir | manbasini tahrirlash]Lyuis asoslari bilan qo'shimchalarning hosil bo'lishi
[tahrir | manbasini tahrirlash]AlH 3 kuchli Lyuis asoslariga ega bo'lgan qo'shimchalarni osongina hosil qiladi. Masalan, trimetilamin bilan 1:1 va 1:2 komplekslari hosil bo'ladi. 1:1 kompleksi gaz fazasida tetraedraldir, , lekin qattiq fazada u vodorod markazlari ko'prik bilan dimerik bo'ladi, (NMe 3 Al(m-H)) 2.[14] 1: 2 kompleksi trigonal bipiramidal tuzilishni qabul qiladi.[15] Ba'zi qo'shimchalar (masalan, dimetiletilamin alan, NMe 2 Et · AlH 3) alyuminiy metall hosil qilish uchun termal parchalanadi va MOCVD ilovalarida foydalanish mumkin.[16]
Uning dietil efir bilan kompleksi quyidagi stexiometriya bo'yicha hosil bo'ladi:
- AlH 3 + (C 2 H 5) 2 O → H 3 Al · O(C 2 H 5) 2
Eterdagi litiy gidrid bilan reaksiya natijasida lityum alyuminiy gidrid hosil bo'ladi :
- AlH 3 + LiH → LiAlH 4
Funktsional guruhlarning qisqarishi
[tahrir | manbasini tahrirlash]Organik kimyoda alyuminiy gidrid asosan funktsional guruhlarni kamaytirish uchun ishlatiladi.[17] Ko'p jihatdan alyuminiy gidridning reaktivligi lityum alyuminiy gidridiga o'xshaydi. Alyuminiy gidrid aldegidlar, ketonlar, karboksilik kislotalar, angidridlar, kislota xloridlari, esterlar va laktonlarni tegishli spirtlarga kamaytiradi. Amidlar, nitrillar va oksimlar mos keladigan aminlar holiga keltiriladi.
Funktsional guruh selektivligi jihatidan alan boshqa gidrid reagentlardan farq qiladi. Masalan, siklogeksanonning quyidagi qaytarilishida lityum alyuminiy gidrid trans: cis nisbati 1,9 ni beradi. : 1, alyuminiy gidrid esa trans: cis nisbati 7,3 ni beradi : 1.[18]

Alan ma'lum ketonlarning gidroksimetilatsiyasini ta'minlaydi (ya'ni CH ni alfa holatida C-CH2OH bilan almashtirish).[19] Ketonning o'zi kamaymaydi, chunki u enolat sifatida "himoyalangan".
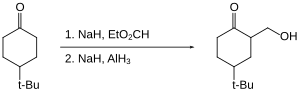
Organogalidlar alyuminiy gidrid bilan sekin yoki umuman qaytarilmaydi. Shuning uchun, karboksilik kislotalar kabi reaktiv funktsional guruhlar galogenidlar ishtirokida kamayishi mumkin.[20]
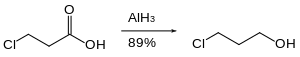
Nitroguruhlar alyuminiy gidrid bilan kamaymaydi. Xuddi shunday, alyuminiy gidrid nitroguruhlar ishtirokida esterni kamaytirishni amalga oshirishi mumkin.[21]

Alyuminiy gidrid asetallarni yarim himoyalangan diollarga kamaytirishda ishlatilishi mumkin.[22]

Alyuminiy gidrid quyida ko'rsatilganidek, epoksid halqasini ochish reaksiyasida ham ishlatilishi mumkin.[23]

Alyuminiy gidrid yordamida amalga oshirilgan alilik qayta tartibga solish reaksiyasi S <sub id="mwARE">N</sub> 2 reaksiyasi bo'lib, u sterik jihatdan talab qilmaydi.[24]
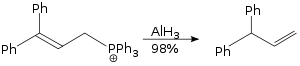
Alyuminiy gidrid hatto isitish ostida karbonat angidridni metanga kamaytiradi:
- 4 AlH 3 + 3 CO 2 → 3 CH 4 + 2 Al 2 O 3
Gidroaluminatsiya
[tahrir | manbasini tahrirlash]Alyuminiy gidrid propargil spirtiga qo'shilishi ko'rsatilgan.[25] Titan tetraklorid bilan birgalikda ishlatiladigan alyuminiy gidrid er- xotin aloqalar bo'ylab qo'shilishi mumkin.[26] Gidroboratsiya ham xuddi shunday reaksiya.

Yoqilg'i
[tahrir | manbasini tahrirlash]Passivlashtirilgan shaklda alan vodorodni saqlash uchun faol nomzod bo'lib, yoqilg'i xujayrasi ilovalari, shu jumladan yonilg'i xujayrasi va elektr transport vositalari va boshqa engil quvvatli ilovalar orqali samarali energiya ishlab chiqarish uchun ishlatilishi mumkin. AlH 3 10% gacha vodorodni o'z ichiga oladi, bu 148 g H 2 / L ga to'g'ri keladi yoki suyuqlik H 2 ning vodorod zichligidan ikki baravar ko'p. O'zining passiv bo'lmagan shaklida, alane ham istiqbolli raketa yoqilg'isi qo'shimchasi bo'lib, impuls samaradorligini 10% gacha oshirishga qodir.[27]
Ehtiyot choralari
[tahrir | manbasini tahrirlash]Alan o'z-o'zidan alangalanmaydi. U lityum alyuminiy gidrid kabi boshqa murakkab metall gidridni kamaytiruvchi vositalarga o'xshash tarzda qo'llanilishi kerak. Alan havoda va suvda parchalanadi, ammo passivatsiya parchalanish tezligini sezilarli darajada kamaytiradi. Passivlashtirilgan alanga odatda 4.3 (suv bilan aloqa qilganda yonuvchi gazlar chiqaradigan kimyoviy moddalar) xavflilik tasnifi beriladi.[28]
Alan bilan triflorometil birikmalarining kamayishi kuchli portlashga olib kelishi mumkin.[29]
Manbalar
[tahrir | manbasini tahrirlash]- ↑ Turley, J. W.; Rinn, H. W. (1969). „The Crystal Structure of Aluminum Hydride“. Inorganic Chemistry. 8-jild, № 1. 18–22-bet. doi:10.1021/ic50071a005.
- ↑ Kurth, F. A.; Eberlein, R. A.; Schnöckel, H.-G.; Downs, A. J.; Pulham, C. R. (1993). „Molecular Aluminium Trihydride, AlH3: Generation in a Solid Noble Gas Matrix and Characterisation by its Infrared Spectrum and ab initio Calculations“. Journal of the Chemical Society, Chemical Communications. 1993-jild, № 16. 1302–1304-bet. doi:10.1039/C39930001302.
- ↑ Andrews, L.; Wang, X. (2003). „The Infrared Spectrum of Al2H6 in Solid Hydrogen“. Science. 299-jild, № 5615. 2049–2052-bet. Bibcode:2003Sci...299.2049A. doi:10.1126/science.1082456. PMID 12663923.
- ↑ Pulham, C. R.; Downs, A. J.; Goode, M. J.; Rankin D. W. H.; Robertson, H. E. (1991). „Gallane: Synthesis, Physical and Chemical Properties, and Structure of the Gaseous Molecule Ga2H6 as Determined by Electron Diffraction“. Journal of the American Chemical Society. 113-jild, № 14. 5149–5162-bet. doi:10.1021/ja00014a003.
- ↑ Brower, F. M.; Matzek, N. E.; Reigler, P. F.; Rinn, H. W.; Schmidt, D. L.; Snover, J. A.; Terada, K. (1976). „Preparation and Properties of Aluminum Hydride“. Journal of the American Chemical Society. 98-jild, № 9. 2450–2454-bet. doi:10.1021/ja00425a011.
- ↑ Finholt, A. E.; Bond, A. C. Jr.; Schlesinger, H. I. (1947). „Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry“. Journal of the American Chemical Society. 69-jild, № 5. 1199–1203-bet. doi:10.1021/ja01197a061.
- ↑ Schmidt, D. L.. Aluminum Trihydride-Diethyl Etherate: (Etherated Alane), Inorganic Syntheses, 1973 — 47–52-bet. DOI:10.1002/9780470132456.ch10. ISBN 9780470132456.
- ↑ Alpatova, N. M.; Dymova, T. N.; Kessler, Yu. M.; Osipov, O. R. (1968). „Physicochemical Properties and Structure of Complex Compounds of Aluminium Hydride“. Russian Chemical Reviews. 37-jild, № 2. 99–114-bet. Bibcode:1968RuCRv..37...99A. doi:10.1070/RC1968v037n02ABEH001617.
- ↑ Semenenko, K. N.; Bulychev, B. M.; Shevlyagina, E. A. (1966). „Aluminium Hydride“. Russian Chemical Reviews. 35-jild, № 9. 649–658-bet. Bibcode:1966RuCRv..35..649S. doi:10.1070/RC1966v035n09ABEH001513.
- ↑ Osipov, O. R.; Alpatova, N. M.; Kessler, Yu. M. (1966). „none“. Elektrokhimiya. 2-jild. 984-bet.
- ↑ 11,0 11,1 Zidan, R.; Garcia-Diaz, B. L.; Fewox, C. S.; Stowe, A. C.; Gray, J. R.; Harter, A. G. (2009). „Aluminium hydride: a reversible material for hydrogen storage“. Chemical Communications. № 25. 3717–3719-bet. doi:10.1039/B901878F. PMID 19557259.
- ↑ 12,0 12,1 Martinez-Rodriguez, M. J.; Garcia-Diaz, B. L.; Teprovich, J. A.; Knight, D. A.; Zidan, R. (2012). „Advances in the electrochemical regeneration of aluminum hydride“. Applied Physics A: Materials Science & Processing. 106-jild, № 25. 545–550-bet. Bibcode:2012ApPhA.106..545M. doi:10.1007/s00339-011-6647-y.
- ↑ Saitoh, H; Sakurai, Y; Machida, A; Katayama, Y; Aoki, K (2010). „In situX-ray diffraction measurement of the hydrogenation and dehydrogenation of aluminum and characterization of the recovered AlH3“. Journal of Physics: Conference Series. 215-jild, № 1. 012127-bet. Bibcode:2010JPhCS.215a2127S. doi:10.1088/1742-6596/215/1/012127. ISSN 1742-6596.
- ↑ Atwood, J. L.; Bennett, F. R.; Elms, F. M.; Jones, C.; Raston, C. L.; Robinson, K. D. (1991). „Tertiary Amine Stabilized Dialane“. Journal of the American Chemical Society. 113-jild, № 21. 8183–8185-bet. doi:10.1021/ja00021a063.
- ↑ Manba xatosi: Invalid
<ref>tag; no text was provided for refs namedgreenwood - ↑ Yun, J.-H.; Kim, B.-Y.; Rhee, S.-W. (1998). „Metal-Organic Chemical Vapor Deposition of Aluminum from Dimethylethylamine Alane“. Thin Solid Films. 312-jild, № 1–2. 259–263-bet. Bibcode:1998TSF...312..259Y. doi:10.1016/S0040-6090(97)00333-7.
- ↑ Galatsis, P. (2001). Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rd245. ISBN 978-0-470-84289-8.
- ↑ Ayres, D. C.; Sawdaye, R. (1967). „The Stereoselective Reduction of Ketones by Aluminium Hydride“. Journal of the Chemical Society B. 1967-jild. 581–583-bet. doi:10.1039/J29670000581.
- ↑ Corey, E. J.; Cane, D. E. (1971). „Controlled Hydroxymethylation of Ketones“. Journal of Organic Chemistry. 36-jild, № 20. 3070-bet. doi:10.1021/jo00819a047.
- ↑ Jorgenson, Margaret J. (July 1962). „Selective reductions with aluminum hydride“. Tetrahedron Letters. 3-jild, № 13. 559–562-bet. doi:10.1016/S0040-4039(00)76929-2.
- ↑ Takano, S.; Akiyama, M.; Sato, S.; Ogasawara, K. (1983). „A Facile Cleavage of Benzylidene Acetals with Diisobutylaluminum Hydride“ (pdf). Chemistry Letters. 12-jild, № 10. 1593–1596-bet. doi:10.1246/cl.1983.1593.[sayt ishlamaydi]
- ↑ Richter, W. J. (1981). „Asymmetric Synthesis at Prochiral Centers: Substituted 1,3-Dioxolanes“. Journal of Organic Chemistry. 46-jild, № 25. 5119–5124-bet. doi:10.1021/jo00338a011.
- ↑ Maruoka, K.; Saito, S.; Ooi, T.; Yamamoto, H. (1991). „Selective Reduction of Methylenecycloalkane Oxides with 4-Substituted Diisobutylaluminum 2,6-Di-tert-butylphenoxides“. Synlett. 1991-jild, № 4. 255–256-bet. doi:10.1055/s-1991-20698.
- ↑ Claesson, A.; Olsson, L.-I. (1979). „Allenes and Acetylenes. 22. Mechanistic Aspects of the Allene-Forming Reductions (SN2' Reaction) of Chiral Propargylic Derivatives with Hydride Reagents“. Journal of the American Chemical Society. 101-jild, № 24. 7302–7311-bet. doi:10.1021/ja00518a028.
- ↑ Corey, E. J.; Katzenellenbogen, J. A.; Posner, G. H. (1967). „New Stereospecific Synthesis of Trisubstituted Olefins. Stereospecific Synthesis of Farnesol“. Journal of the American Chemical Society. 89-jild, № 16. 4245–4247-bet. doi:10.1021/ja00992a065.
- ↑ Sato, F.; Sato, S.; Kodama, H.; Sato, M. (1977). „Reactions of Lithium Aluminum Hydride or Alane with Olefins Catalyzed by Titanium Tetrachloride or Zirconium Tetrachloride. A Convenient Route to Alkanes, 1-Haloalkanes and Terminal Alcohols from Alkenes“. Journal of Organometallic Chemistry. 142-jild, № 1. 71–79-bet. doi:10.1016/S0022-328X(00)91817-5.
- ↑ Calabro, M. (2011). „Overview of Hybrid Propulsion“. Progress in Propulsion Physics. 2-jild. 353–374-bet. Bibcode:2011EUCAS...2..353C. doi:10.1051/eucass/201102353. ISBN 978-2-7598-0673-7.
- ↑ 2013 CFR Title 29 Volume 6 Section 1900.1200 Appendix B.12
- ↑ Taydakov, Ilya V. (2020-07-08). „Serious Explosion during Large-Scale Preparation of an Amine by Alane (AlH3) Reduction of a Nitrile Bearing a CF3 Group“. ACS Chemical Health & Safety. 27-jild, № 4. American Chemical Society (ACS). 235–239-bet. doi:10.1021/acs.chas.0c00045. ISSN 1871-5532.
Havolalar
[tahrir | manbasini tahrirlash]- EnvironmentalChemistry.com kimyoviy ma'lumotlar bazasida alyuminiy gidrid
- Brookhaven milliy laboratoriyasidan vodorodni saqlash
- WebElements-da alyuminiy trigidrid







